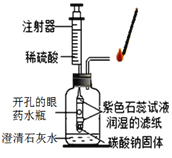
题目内容
【题目】为了防止食品腐败,在许多食品包装盒中都有一包黑色粉末。这种粉末是一种除氧剂。该粉末没有失效时呈黑色,失效后带有红棕色。为了确定该粉末的成分,小明做出了以下的猜想:
猜想1:该粉末是木炭粉;
猜想2:该粉末是铁粉;
猜想3:该粉末是木炭粉和铁粉的混合物。
小明取没有失效的该粉末,分别用不同的方法进行如下实验,填写表中空格。
实验操作 | 实验现象 | 猜想是否成立 | |
实验1 | 加入足量的_____溶液 | 黑色粉末全部溶解,溶液由蓝色变成浅绿色,有红色固体生成 | 猜想1:不成立 |
实验2 | 加入足量的稀盐酸 | _____ | 猜想2:成立 |
实验3 | 用磁铁吸引 | 粉末被全部吸引 | 猜想3:_____ |
现象与写出实验1反应的化学方程式_____。
(交流与反思)
(1)根据失效后的颜色判断,该粉末失效的原因是_____。
(2)采用什么实验方法可以使失效的粉末“再生”?_____(用化学方程式表示)
【答案】硫酸铜 黑色粉末逐渐溶解,有大量的气泡产生 不成立 Fe+CuSO4═FeSO4+Cu 铁与空气中的氧气和水反应生成了铁锈 3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
【解析】
根据猜想可知,黑色粉末可能为木炭粉、铁粉中的一种或两种的混合物,可利用铁粉与木炭粉性质的差别,对固体粉末的组成进行检验。
实验1:由题给实验现象及猜想1不成立可推出,向黑色粉末中加入的是能使溶液由蓝色变成浅绿色且有红色固体生成的硫酸铜溶液;
实验2:由题给猜想2成立知,向黑色粉末(铁粉)中加入足量的稀盐酸,反应的现象为黑色粉末逐渐溶解并放出气体;
猜想3:磁铁可以吸引铁粉而不能吸引木炭粉,用磁铁吸引时出现粉末全部被吸起,可说明猜想3不成立;
现象与实验1中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式:Fe+CuSO4═FeSO4+Cu。
【交流与反思】(1)铁在潮湿的空气中生锈可形成红色的铁锈而失效;
(2)使失效的粉末“再生”可在高温条件下,用CO还原氧化铁得到铁粉,达到“再生”的目的,反应的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。

 名校课堂系列答案
名校课堂系列答案【题目】某同学对若干块矿石样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)8g的石灰石样品中含有杂质 克?
(2)如表中m的数值应为 ?
(3)稀盐酸的质量分数是多少?