题目内容
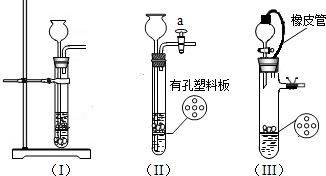
(1)某化学活动小组对实验室制取气体的发生装置进行探究.下图是改进后的实验装置图:
(ⅰ)检查装置(Ⅱ)气密性的方法是______;
(ⅱ)小松同学选用装置(Ⅱ)来制取CO2,现有①Na2CO3固体、②块状大理石、③稀盐酸、④稀硫酸,他应选用的试剂是______.(填番号)
(ⅲ)装置(Ⅲ)橡皮管的作用是______.
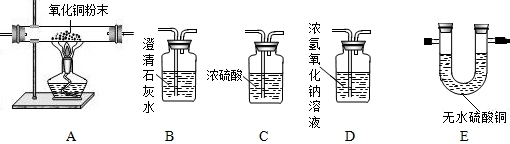
(2)水蒸气通过炽热的焦炭所产生的一氧化碳和氢气的混合气体叫水煤气.所制取的水煤气还含有二氧化碳和水蒸气.请选用如下装置设计实验,确认水煤气中含有氢气和一氧化碳.

(ⅰ)水煤气通过实验的正确连接顺序是______(用字母表示);
(ⅱ)描述能确认水煤气中含有H2的现象:______;含有CO的现象:______.
(ⅲ)该实验尾气的处理方法是______.
【答案】分析:(1)检查装置的气密性装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡;根据反应的速率和操控的难以程度选择药品.根据装置内压强的改变分析反应现象.
(2)验证一氧化碳是利用一氧化碳与氧化铜反应既能还原氧化铜,又能生成二氧化碳,验证氢气是利用氢气与氧化铜反应既能还原氧化铜,又能生成水,所以要把原来的水和二氧化碳除掉;根据除杂质的连接原则考虑;考虑氢气、一氧化碳还原氧化铜的现象和生成水的检验现象;由于一氧化碳还原氧化铜时尾气中会混有污染性气体,再考虑除去的方法.
解答:解:(1)(ⅰ)根据检查装置气密性的原理确定检查方法为:关闭a,向长颈漏斗加水至液斗内形成一段水柱,观察水柱变化,若液面不下降,则装置不漏气.
(ⅱ)块状大理石可放在有空的塑料板上,酸要用盐酸,因为硫酸和碳酸钙生成硫酸钙是微溶的,附着在大理石表面,阻止反应进一步进行,反应进行过程中,碳酸钠与酸反应速度太快来不及收集,故选择大理石和稀盐酸.
(ⅲ)装置(Ⅲ)橡皮管的作用是 使分液漏斗和试管内外压强相等,便于液体顺畅流下.
(2)(ⅰ)要验证一氧化碳和氢气必须先除去原来的二氧化碳和水,要先通过氢氧化钠除去二氧化碳,再通过浓硫酸除去水,否则再通过氢氧化钠时,又会带上水,除去二氧化碳和水,再通过氧化铜,在验证生成物时要先验证有没有水,通过无水硫酸铜,看是否变蓝,变蓝说明有水生成,再通过石灰水看是否变浑浊,变浑浊说明有二氧化碳生成,即原气体中有一氧化碳;故连接顺序为:D→C→A→E→B
(ⅱ)由于氢气能还原氧化铜,使黑色粉末变成红色,并能生成水,能使白色的无水硫酸铜变成蓝色;由于一氧化碳能还原氧化铜,使黑色粉末变成红色,并能生成二氧化碳,使澄清石灰水变浑浊;
(ⅲ)由于一氧化碳还原氧化铜时尾气中会混有大量一氧化碳,而一氧化碳有毒,能污染空气,所以缺点是缺少尾气处理装置,应该将尾气点燃或用气袋收集.
故答案为:(ⅰ)关闭a,向长颈漏斗加水至液斗内形成一段水柱,观察水柱变化,若液面不下降,则装置不漏气;
(ⅱ) ②③.
(ⅲ) 使分液漏斗和试管内外压强相等,便于液体顺畅流下.
(2)(ⅰ) D→C→A→E→B;
(ⅱ):A中有红色物质生成,E中有无水硫酸铜变蓝; A中有红色物质成,B中澄清石灰水变浑浊.
(ⅲ) 将尾气作点燃燃烧处理,或用气袋收集.
点评:除杂质时要把水放到最后除,如果验证水的存在时要把验证水的存在的无水硫酸铜放在最前面.
(2)验证一氧化碳是利用一氧化碳与氧化铜反应既能还原氧化铜,又能生成二氧化碳,验证氢气是利用氢气与氧化铜反应既能还原氧化铜,又能生成水,所以要把原来的水和二氧化碳除掉;根据除杂质的连接原则考虑;考虑氢气、一氧化碳还原氧化铜的现象和生成水的检验现象;由于一氧化碳还原氧化铜时尾气中会混有污染性气体,再考虑除去的方法.
解答:解:(1)(ⅰ)根据检查装置气密性的原理确定检查方法为:关闭a,向长颈漏斗加水至液斗内形成一段水柱,观察水柱变化,若液面不下降,则装置不漏气.
(ⅱ)块状大理石可放在有空的塑料板上,酸要用盐酸,因为硫酸和碳酸钙生成硫酸钙是微溶的,附着在大理石表面,阻止反应进一步进行,反应进行过程中,碳酸钠与酸反应速度太快来不及收集,故选择大理石和稀盐酸.
(ⅲ)装置(Ⅲ)橡皮管的作用是 使分液漏斗和试管内外压强相等,便于液体顺畅流下.
(2)(ⅰ)要验证一氧化碳和氢气必须先除去原来的二氧化碳和水,要先通过氢氧化钠除去二氧化碳,再通过浓硫酸除去水,否则再通过氢氧化钠时,又会带上水,除去二氧化碳和水,再通过氧化铜,在验证生成物时要先验证有没有水,通过无水硫酸铜,看是否变蓝,变蓝说明有水生成,再通过石灰水看是否变浑浊,变浑浊说明有二氧化碳生成,即原气体中有一氧化碳;故连接顺序为:D→C→A→E→B
(ⅱ)由于氢气能还原氧化铜,使黑色粉末变成红色,并能生成水,能使白色的无水硫酸铜变成蓝色;由于一氧化碳能还原氧化铜,使黑色粉末变成红色,并能生成二氧化碳,使澄清石灰水变浑浊;
(ⅲ)由于一氧化碳还原氧化铜时尾气中会混有大量一氧化碳,而一氧化碳有毒,能污染空气,所以缺点是缺少尾气处理装置,应该将尾气点燃或用气袋收集.
故答案为:(ⅰ)关闭a,向长颈漏斗加水至液斗内形成一段水柱,观察水柱变化,若液面不下降,则装置不漏气;
(ⅱ) ②③.
(ⅲ) 使分液漏斗和试管内外压强相等,便于液体顺畅流下.
(2)(ⅰ) D→C→A→E→B;
(ⅱ):A中有红色物质生成,E中有无水硫酸铜变蓝; A中有红色物质成,B中澄清石灰水变浑浊.
(ⅲ) 将尾气作点燃燃烧处理,或用气袋收集.
点评:除杂质时要把水放到最后除,如果验证水的存在时要把验证水的存在的无水硫酸铜放在最前面.

练习册系列答案
相关题目
 (2006?眉山)(1)某化学活动小组对实验室制取气体的发生装置进行探究.下图是改进后的实验装置图:
(2006?眉山)(1)某化学活动小组对实验室制取气体的发生装置进行探究.下图是改进后的实验装置图: