题目内容
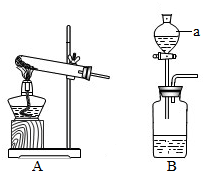
实验室常用氯酸钾晶体和二氧化锰粉末制取氧气(装置A),也可用过氧化氢溶液和二氧化锰粉末来制取氧气(装置B).装置B中的仪器⑤是分液漏斗,通过活塞的“开”、“关”可以随时滴加过氧化氢溶液.
(1)写出装置A、B中编号的仪器名称:①
(2)比较两种制取方法的异同:
(3)上述两个反应中二氧化锰的作用是
(4)若用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的
(1)写出装置A、B中编号的仪器名称:①
试管
试管
,④锥形瓶
锥形瓶
.(2)比较两种制取方法的异同:
| 对比 | 氯酸钾晶体和二氧化锰粉末 | 过氧化氢溶液和二氧化锰粉末 |
| 气体发生装置 |  装置A |
 装置B |
| 反应物的状态 | ||
| 反应的条件 | ||
| 反应的化学方程式 | ||
| 产生1mol氧气 需要的氯酸钾 或过氧化氢的 物质的量 |
(选择其中的一种,写出计算过程) | |
催化作用
催化作用
,反应的基本类型都属于分解
分解
反应.(4)若用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的
密度大于空气的密度
密度大于空气的密度
、助燃性
助燃性
性质.分析:(1)根据常见实验仪器的名称以及作用进行解答;
(2)根据观察图示AB,比较反应物状态和反应条件的区别;
(3)根据两个反应中二氧化锰是催化剂以及反应物和生成物的种类多少判断反应类型;
(4)根据氧气的密度大于空气的密度以及氧气的助燃性进行解答.
(2)根据观察图示AB,比较反应物状态和反应条件的区别;
(3)根据两个反应中二氧化锰是催化剂以及反应物和生成物的种类多少判断反应类型;
(4)根据氧气的密度大于空气的密度以及氧气的助燃性进行解答.
解答:解:(1)A、B中编号的仪器名称:①试管;④锥形瓶;
(2)装置A,反应物的状态是固体,反应条件是加热,反应的化学方程式:2KClO3
2KCl+3O2↑;
装置B,反应物的状态是液体和固体,反应的条件是不需加热,反应的化学方程式:2H2O2
2H2O+O2↑;
设产生1mol氧气需要的氯酸钾的质量为x.
1mol氧气的质量为32g
2KClO3
2KCl+3O2↑
245 96
x 32g
=
x=81.7g
答:产生1mol氧气需要的氯酸钾的质量为81.7g.
(3)两个反应中二氧化锰是催化剂,反应物为一种,生成物为多种,属于分解反应;
(4)用向上排空气法收集氧气,说明氧气的密度大于空气的密度;用带火星的木条放在集气瓶口检验氧气是否收集满,说明氧气的助燃性.
故答案为:(1):①试管;④锥形瓶;
(2)装置A,反应物的状态是固体,反应条件是加热,反应的化学方程式:2KClO3
2KCl+3O2↑;
装置B,反应物的状态是液体和固体,反应的条件是不需加热,反应的化学方程式:2H2O2
2H2O+O2↑;
设产生1mol氧气需要的氯酸钾的质量为x.
1mol氧气的质量为32g
2KClO3
2KCl+3O2↑
245 96
x 32g
=
x=81.7g
答:产生1mol氧气需要的氯酸钾的质量为81.7g.
(3)催化作用;分解;
(4)密度大于空气的密度;助燃性.
(2)装置A,反应物的状态是固体,反应条件是加热,反应的化学方程式:2KClO3
| ||
| △ |
装置B,反应物的状态是液体和固体,反应的条件是不需加热,反应的化学方程式:2H2O2
| ||
设产生1mol氧气需要的氯酸钾的质量为x.
1mol氧气的质量为32g
2KClO3
| ||
| △ |
245 96
x 32g
| 245 |
| x |
| 96 |
| 32g |
x=81.7g
答:产生1mol氧气需要的氯酸钾的质量为81.7g.
(3)两个反应中二氧化锰是催化剂,反应物为一种,生成物为多种,属于分解反应;
(4)用向上排空气法收集氧气,说明氧气的密度大于空气的密度;用带火星的木条放在集气瓶口检验氧气是否收集满,说明氧气的助燃性.
故答案为:(1):①试管;④锥形瓶;
(2)装置A,反应物的状态是固体,反应条件是加热,反应的化学方程式:2KClO3
| ||
| △ |
装置B,反应物的状态是液体和固体,反应的条件是不需加热,反应的化学方程式:2H2O2
| ||
设产生1mol氧气需要的氯酸钾的质量为x.
1mol氧气的质量为32g
2KClO3
| ||
| △ |
245 96
x 32g
| 245 |
| x |
| 96 |
| 32g |
x=81.7g
答:产生1mol氧气需要的氯酸钾的质量为81.7g.
(3)催化作用;分解;
(4)密度大于空气的密度;助燃性.
点评:本题以实验探究的形式考查制取氧气的化学反应式的书写、反应物的状态和条件与装置之间的关系,培养学生根据的总结能力.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
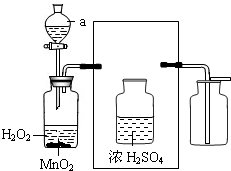 实验室常用氯酸钾晶体和二氧化锰粉末制取氧气(装置A),也可用过氧化氢溶液和催化剂二氧化锰粉末来制取氧气(装置B).装置B中的仪器a是分液漏斗,通过活塞的“开”、“关”可以随时滴加过氧化氢溶液,从而控制得到氧气的量.
实验室常用氯酸钾晶体和二氧化锰粉末制取氧气(装置A),也可用过氧化氢溶液和催化剂二氧化锰粉末来制取氧气(装置B).装置B中的仪器a是分液漏斗,通过活塞的“开”、“关”可以随时滴加过氧化氢溶液,从而控制得到氧气的量.(1)写出一种实验室制取氧气的化学方程式:
(2)从反应物状态和反应条件来比较装置A和B的差异:
| 装置A | 装置B | |
| 反应物状态 | ||
| 反应条件 |
(4)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满.这是利用了氧气的