题目内容
【题目】在化学实验中水不仅能用于配制溶液,还能扮演其它不同的角色。
(一)某同学配制100g溶质质量分数为5%的氯化钠溶液,请回答下列问题:
(1)若用氯化钠固体和水配制,实验步骤为计算、_____、溶解。
(2)若用溶质质量分数为20%的氯化钠溶液和水配置,则需20%的氯化钠溶液质量为_____g。
(二)请根据下列实验装置图回答下列问题:
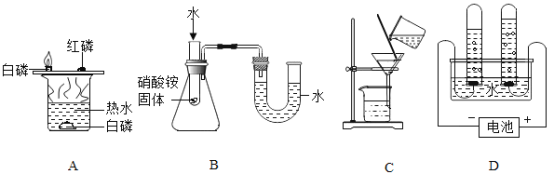
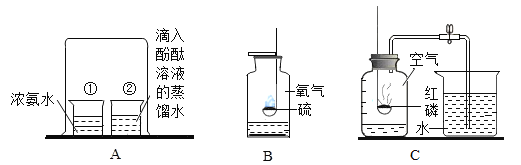
(3)实验A中热水的作用是提供热量和_____。
(4)实验B,滴加水后看到U型管中_____(填“左边”或“右边”)液面升高。
(5)C图所示操作的名称为_____,其中玻璃棒的作用是_____。
(6)D中电解水实验能得到的结论是:水是由_____组成的。
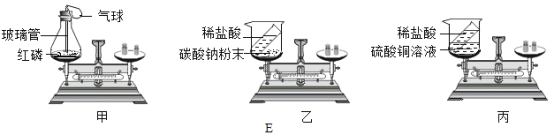
(7)为了给上述D实验提供理论依据,某同学用E图中三个装置验证质量守恒定律(友情提示:盐酸与硫酸铜不反应),能得到正确结论的装置为_____(填序号)。由此可知验证质量守恒定律时,需注意的是_____(只回答一条即可)。试从微观角度分析化学反应前后质量守恒的原因是_____。
(三)下列是初中化学常见的四个实验,回答下列问题:
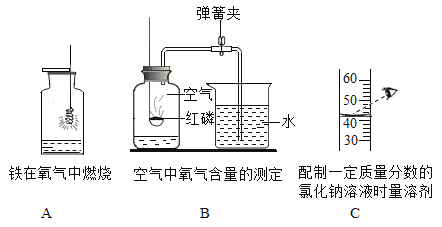
(8)A实验中集气瓶内预先装少量水的目的是_____。
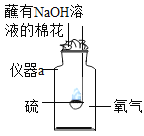
(9)B实验中导致实验结果偏小的原因是_____(只写一个)。
(10)C实验中该操作将导致所配溶液溶质质量分数_____(填“偏大”、“偏小”或“不变”)。
(11)配置溶液的过程中,玻璃棒的作用是:_____。
【答案】称量 25 隔绝空气 左边 过滤 引流 氢、氧两种元素 甲 一定发生化学变化或有气体产生的反应需要在密闭装置中进行(答案合理即可) 原子数目不发生改变,原子种类不发生改变原子,原子质量不发生改变 防止高温熔融物溅落,造成集气瓶炸裂 装置气密性不好或红磷的使用量不足(答案合理即可) 偏大 搅拌,加速溶解
【解析】
(1)若用氯化钠固体和水配制,实验步骤为计算、称量、溶解。
(2)若用溶质质量分数为20%的氯化钠溶液和水配置,
设需20%的氯化钠溶液质量为m。
已知:配置溶液前、后,溶质质量不变,
100g×5%=m![]() 20%;解之得:m=25g。
20%;解之得:m=25g。
(3)实验A中热水的作用是提供热量和隔绝空气。
(4)实验B,硝酸铵与水反应吸热,装置内温度降低,压强变小;滴加水后看到U型管中左边液面升高。
(5)C图所示操作的名称为过滤,其中玻璃棒的作用是引流。
(6)D中电解水实验能得到的结论是:水是由氢、氧两种元素组成的。
(7)为了给上述D实验提供理论依据,某同学用E图中三个装置验证质量守恒定律,能得到正确结论的装置为
甲、红磷在密闭环境中与空气中的氧气发生化学反应;能验证质量守恒定律;
乙、稀盐酸与碳酸钠反应产生二氧化碳气体,排放在空气中,不能验证质量守恒定律;
丙:稀盐酸与硫酸铜溶液不发生化学反应,不能验证质量守恒定律;
故选:甲;
由此可知验证质量守恒定律时,需注意的是:①一定发生化学变化②有气体产生的反应需要在密闭装置中进行。试从微观角度分析化学反应前后质量守恒的原因是:原子数目不发生改变,原子种类不发生改变原子,原子质量不发生改变。
(8)A实验中集气瓶内预先装少量水的目的是:防止高温熔融物溅落,造成集气瓶炸裂。
(9)B实验中导致实验结果偏小的原因是:①装置气密性不好②红磷的使用量不足。
(10)用量筒俯视读数量取液体体积,量取的实际体积小于读数体积,溶质质量不变,溶剂质量减小,则溶质质量分数变大,C实验中该操作将导致所配溶液溶质质量分偏大。
(11)配置溶液的过程中,玻璃棒的作用是:搅拌加速溶解。