题目内容
 (2012?衡阳)如图是某胃药标签上的部分内容,振衡中学化学兴趣小组欲测定该药品中碳酸氢钠(NaHCO3)的质量分数,取10片该药品研碎放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水,也不参加反应),共消耗稀盐酸23g,测得反应后烧杯内物质的总质量为25.8g.请计算:
(2012?衡阳)如图是某胃药标签上的部分内容,振衡中学化学兴趣小组欲测定该药品中碳酸氢钠(NaHCO3)的质量分数,取10片该药品研碎放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(杂质不溶于水,也不参加反应),共消耗稀盐酸23g,测得反应后烧杯内物质的总质量为25.8g.请计算:(1)10片药品的质量为
5
5
g,反应共生成气体的质量为2.2
2.2
g.(2)药品中碳酸氢钠的质量分数.
(3)反应后所得溶液中溶质的质量分数.(计算结果保留到0.1%)
分析:(1)根据100片药品重50g计算出每片质量再算10片的质量;根据烧杯内质量的减少量就是二氧化碳的质量;(2)根据二氧化碳的质量计算出碳酸氢钠的质量,再除以药品的质量即可;(3)根据二氧化碳的质量算出反应后生成的溶质质量,再除以反应后所得溶液的质量即可.
解答:解:(1)100片药品重50g计算出每片质量为:
=0.5g,所以10片药品的质量为0.5g×10=5g;反应共生成气体的质量为5g+23g-25.8g=2.2g;
(2)设要生成2.2g二氧化碳需要参加反应的碳酸氢钠质量为X,生成氯化钠质量为Y则:
NaHCO3+HCl═NaCl+H2O+CO2↑
84 58.5 44
X Y 2.2g
根据:
=
解得X=4.2g,根据
=
解得Y=2.925g
药品中碳酸氢钠的质量分数
×100%=84%;
(3)反应后所得溶液质量为:4.2g+23g-2.2g=25g.反应后所得溶液中溶质的质量分数:
×100%=11.7%.
故答案为:(1)5;2.2;(2)84%;(3)11.7%.
| 50g |
| 100片 |
(2)设要生成2.2g二氧化碳需要参加反应的碳酸氢钠质量为X,生成氯化钠质量为Y则:
NaHCO3+HCl═NaCl+H2O+CO2↑
84 58.5 44
X Y 2.2g
根据:
| 84 |
| 44 |
| X |
| 2.2g |
| 58.5 |
| 44 |
| Y |
| 2.2g |
药品中碳酸氢钠的质量分数
| 4.2g |
| 5g |
(3)反应后所得溶液质量为:4.2g+23g-2.2g=25g.反应后所得溶液中溶质的质量分数:
| 2.925g |
| 25g |
故答案为:(1)5;2.2;(2)84%;(3)11.7%.
点评:本题容易出错的地方是反应后所得溶液的计算,杂质不能加入,只能加碳酸氢钠和盐酸质量,再减去气体的质量.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
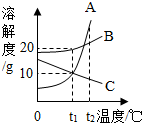 (2012?衡阳)如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答.
(2012?衡阳)如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答.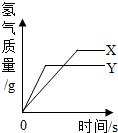 (2012?衡阳)将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答:
(2012?衡阳)将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答: