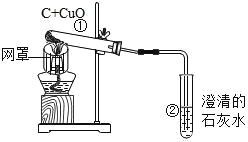
题目内容
【题目】建湖是美丽水乡。
(1)小明取了西塘河水,按下列流程进行实验,制取蒸馏水。请回答下列问题:
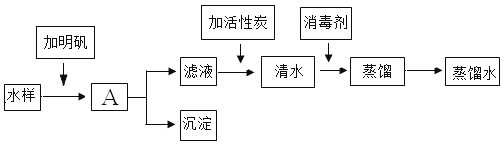
①操作A的名称是______。
②滤液中加活性炭,滤液变成清水,是______变化(填“物理”或“化学”)。
③生活中常用______来比较所取水样与制得的蒸馏水的硬度。
④消毒剂为高铁酸钠(Na2FeO4)。高铁酸钠中铁元素的化合价为______。
(2)如图是A、B、C三种物质的溶解度曲线,请回答:
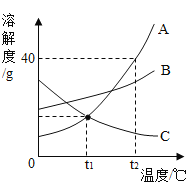
①在t2℃时,将30gA物质充分溶解在盛有50g水的烧杯中,所得溶液的质量为______g;若将烧杯内物质降温至t1℃(不考虑水蒸发),溶液中变化的是______(填字母序号)。
a溶剂的质量 b溶液的质量 c溶质的质量分数
②当A物质中混有少量B、C两种物质时,采用______的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是______。
(3)实验室用质量分数为 98%的浓硫酸(密度为1.84g/cm3)配制 49g 质量分数为20%的稀硫酸。
①经计算,所需 98%的浓硫酸的体积为______mL 。
②若量取水时仰视读数,其它操作均正确,则配制的稀硫酸中溶质质量分数_____20% (填“>”“<”或“ = ”)。
③向该49g20%的稀硫酸中,加入7.3g已部分氧化的锌粉,恰好完全反应。则所得溶液中溶质的质量为(______)(填字母序号)
A15.5g B16.1g C18.1g
【答案】过滤 物理 肥皂水 +6 70 bc 降温结晶 BAC 5.4 < B
【解析】
(1)结合流程图可知:
①操作A的名称是过滤,将沉淀和滤液分离。
②滤液中加活性炭,利用活性炭吸附性吸附有色物质,滤液变成清水,是物理变化。
③生活中常用肥皂水来比较所取水样与制得的蒸馏水的硬度。
④消毒剂为高铁酸钠(Na2FeO4)。已知钠元素为+1价,氧元素为-2价,设铁元素的化合价为x,则根据化学式中元素化合价代数和为0有![]() ,解得x=+6,故高铁酸钠中铁元素的化合价为+6价。
,解得x=+6,故高铁酸钠中铁元素的化合价为+6价。
(2)由A、B、C三种物质的溶解度曲线可知:
①在t2℃时,A物质的溶解度是40g,即t2℃时,100g水中最多溶解A物质的质量为40g,将30gA物质充分溶解在盛有50g水的烧杯中,最多只能溶解20g,故所得溶液的质量为20g+50g=70g;若将烧杯内物质降温至t1℃(不考虑水蒸发),A物质的溶解度随温度的降低而减小,会有A物质晶体析出,故溶液中变化的是:b溶液的质量和c溶质的质量分数。
②当A物质中混有少量B、C两种物质时,A物质溶解度受温度影响比B、C两种物质的大,可采用降温结晶的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,A、B都会析出晶体,仍为饱和溶液,C由饱和溶液变为不饱和溶液,t1℃时,A的溶解度小于B的溶解度,大于t2℃时C的溶解度,因此将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是BAC。
(3)实验室用质量分数为 98%的浓硫酸(密度为1.84g/cm3)配制 49g 质量分数为20%的稀硫酸。
①设所需98%的浓硫酸的体积为V,则有![]() ,解得V
,解得V![]() 5.4mL,即所需98%的浓硫酸的体积为5.4mL。
5.4mL,即所需98%的浓硫酸的体积为5.4mL。
②若量取水时仰视读数,其它操作均正确,量取的水的体积偏大,溶剂质量偏大,则配制的稀硫酸中溶质质量分数<20%。
③向该49g20%的稀硫酸中,加入7.3g已部分氧化的锌粉,恰好完全反应。则所得溶液中溶质的质量为硫酸锌,可根据硫酸与硫酸锌中硫酸根的质量守恒进行计算,设所得硫酸锌的质量为x,则有:
![]()
解得x=16.1g,即所得硫酸锌的质量为16.1g,B选项正确,符合题意。故选B。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】石灰石是重要的矿石之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)哪几次反应中矿石中碳酸钙有剩余:________
(2)上表中m的数值是________
(3)试计算出这种石灰石矿中碳酸钙的质量分数________