题目内容
【题目】实验室里有一包样品是由氢氧化钠和氧化铜组成,为了测定其中氧化铜的质量,现将该样品倒入烧杯中(不考虑实验中造成的损失),并取100 g溶质质量分数为14. 6%的稀盐酸加入烧杯中,充分反应后烧杯中只得到中性溶液,其中溶剂的质量是90. 8g,则原混合物中氧化铜的质量为(假设氯化铜溶液为中性)( )
A.4g
B.8g
C.12g
D.16g
【答案】B
【解析】
氢氧化钠和盐酸反应生成氯化钠和水,氧化铜与盐酸反应生成氯化铜和水,反应的化学方程式分别为:NaOH+HCl=NaCl+H2O, CuO+2HCl=CuCl2+H2O,反应生成水的质量90.8g-(100g-100g×14.6%)=5.4g。参加反应的盐酸的溶质(HCl)的质量为100g×14.6%=14.6g。
设:与氧化铜反应的HCl质量为x,生成水的质量为y,参加反应的氧化铜的质量为z;
与氢氧化钠反应的HCl质量为(14.6g-x),生成水的质量为(5.4g-y) 。
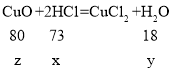
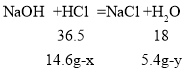
![]() ……①
……① ![]() ……②
……②
①②联列,解得x=7.3g,y=1.8g;
![]() z=8.0g。故选B。
z=8.0g。故选B。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目