题目内容
(8分)小奇同学在实验室开放日做了氧化铜和稀硫酸反应的实验后,发现实验桌上有一瓶标签残缺(如左下图所示)的NaOH溶液。为了测定此溶液的溶质质量分数,他决定利用氧化铜和稀硫酸反应后的废液。他将废液过滤,然后取100g滤液,慢慢滴加此NaOH溶液,已知当溶液中存在酸和盐时,碱先和酸反应。加入NaOH溶液的质量与生成沉淀质量的关系如右下图所示:

(1)氧化铜和稀硫酸反应的废液中,溶质为__________和硫酸铜。
(2)计算100g滤液中CuSO4的质量;
(3)计算此氢氧化钠溶液中溶质的质量分数。

(1)氧化铜和稀硫酸反应的废液中,溶质为__________和硫酸铜。
(2)计算100g滤液中CuSO4的质量;
(3)计算此氢氧化钠溶液中溶质的质量分数。
设100 g滤液中CuSO4的质量为x,生成4.9g沉淀的NaOH质量为y(1分)
CuSO4+ 2NaOH =" Cu" (OH)2↓+Na2SO4 (4分)
160 80 98
x y 4.9g(5分)

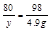
x=8g y=4g
此氢氧化钠溶液中溶质的质量分数= ×100%=20%
×100%=20%
答:(1)100g滤液中CuSO4的质量是8g;(2)此氢氧化钠溶液中溶质的质量分数是20%。
CuSO4+ 2NaOH =" Cu" (OH)2↓+Na2SO4 (4分)
160 80 98
x y 4.9g(5分)

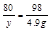
x=8g y=4g
此氢氧化钠溶液中溶质的质量分数=
 ×100%=20%
×100%=20%答:(1)100g滤液中CuSO4的质量是8g;(2)此氢氧化钠溶液中溶质的质量分数是20%。
(1)在加入氢氧化钠溶液的过程中,开始时没有发现沉淀生成,是因为氢氧化钠溶液在与稀硫酸反应,说明氧化铜和稀硫酸反应中稀硫酸有剩余.故答案为:H2SO4.
(2)解:设100g滤液中CuSO4的质量为x,与CuSO4反应生成4.9g沉淀的NaOH质量为y,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98
x y 4.9g

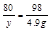
x=8g y=4g
此氢氧化钠溶液中溶质的质量分数= ×100%=20%
×100%=20%
答:(1)100g滤液中CuSO4的质量是8g;(2)此氢氧化钠溶液中溶质的质量分数是20%。
(2)解:设100g滤液中CuSO4的质量为x,与CuSO4反应生成4.9g沉淀的NaOH质量为y,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98
x y 4.9g

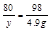
x=8g y=4g
此氢氧化钠溶液中溶质的质量分数=
 ×100%=20%
×100%=20%答:(1)100g滤液中CuSO4的质量是8g;(2)此氢氧化钠溶液中溶质的质量分数是20%。

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目