题目内容
在实验室制取氧气时,取一定质量的MnO2和KClO3的固体混合物加热至不再产生气体为止,收集到一定质量的氧气.某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出.加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)可能用到的相对原子质量:K-39 Cl-35.5 O-16| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
(2)求所制得氧气的质量.
【答案】分析:(1)由图表可知,加入10g水最多溶解KCl的质量和第三、第四次加水后溶解KCl的质量,比较可知剩余的固体全部是不溶于水的MnO2,据此答题;
(2)根据化学方程式,可以得出各物质之间的质量比,写出比例式,就可计算得出所制得氧气的质量.
解答:解:(1)由1和2可知加入10g水最多溶解7.25g-4.05g=3.2gKCl,而第三、第四次加水后溶解KCl为4.05g-3g<3.2g,
则第三次加水后KCl完全溶解,剩余的固体全部是不溶于水的MnO2,则m=3
(2)由分析知10g水能溶解氯化钾的质量是3.2g,则反应生成的氯化钾质量应该为7.25g-3g+3.2g=7.45g
解:设可制得氧气的质量为x
2KClO3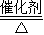 2KCl+3O2↑
2KCl+3O2↑
149 96
7.45g x
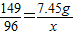
x=4.8 g
故答案为:(1)3;(2)答:可制得氧气4.8克.
点评:本题主要考查学生根据已知条件进行分析的能力,以及运用化学方程式进行计算的能力.
(2)根据化学方程式,可以得出各物质之间的质量比,写出比例式,就可计算得出所制得氧气的质量.
解答:解:(1)由1和2可知加入10g水最多溶解7.25g-4.05g=3.2gKCl,而第三、第四次加水后溶解KCl为4.05g-3g<3.2g,
则第三次加水后KCl完全溶解,剩余的固体全部是不溶于水的MnO2,则m=3
(2)由分析知10g水能溶解氯化钾的质量是3.2g,则反应生成的氯化钾质量应该为7.25g-3g+3.2g=7.45g
解:设可制得氧气的质量为x
2KClO3
 2KCl+3O2↑
2KCl+3O2↑149 96
7.45g x
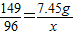
x=4.8 g
故答案为:(1)3;(2)答:可制得氧气4.8克.
点评:本题主要考查学生根据已知条件进行分析的能力,以及运用化学方程式进行计算的能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气.某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出.加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
试求:(2KClO3-245,O2-32)
(1)写出氯酸钾、二氧化锰混合加热的化学方程式: ;
(2)加热t3时间后,小明认为氯酸钾已经完全反应,请你帮他说明理由? ;
(3)小华根据质量守恒定律很快得到O2的质量是 g;
(4)请你通过计算,帮助他们说明该药品氯酸钾是否纯净.
| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
(1)写出氯酸钾、二氧化锰混合加热的化学方程式:
(2)加热t3时间后,小明认为氯酸钾已经完全反应,请你帮他说明理由?
(3)小华根据质量守恒定律很快得到O2的质量是
(4)请你通过计算,帮助他们说明该药品氯酸钾是否纯净.
在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气.某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出.加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
试求:(1)表中m值为 ;
(2)混合物中KClO3的质量 ;
(3)所制得氧气的质量(写出具体计算过程). .
| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
(2)混合物中KClO3的质量
(3)所制得氧气的质量(写出具体计算过程).