题目内容
下表是元素周期表的一部分:
| 族 周期 | IA | | 0 | |||||
| 1 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
| 2 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 3 | 11 Na 22.99 | 12 Mg 24.31 | 13 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)地壳中含量最多的金属元素符号 ;人体内含量最高的元素名称 ; 由1、8、12号三种元素组成化合物的化学式 。
(2)相对原子质量为35.45的元素是 (填“金属”或“非金属”)元素,它在反应中容易 (填“得到”或“失去”)电子;氦元素最外层电子数为 ,表中与其化学性质相似的元素是 。
(3)表中不同种元素最本质的区别是 (填序号)
A.质子数不同 B.相对原子质量不同 C.电子数不同
(4)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个(填粒子符号)阳离子 ,阴离子 。
(1)Al 氧 Mg(OH)2
(2)非金属 得到 2 氖和氩
(3)A
(4)Na+ O2-
解析试题分析:(1)地壳中含量最多的元素依次为氧、硅、铝、铁,其中氧、硅为非金属,铝、铁为金属。人体中含量最多的元素是氧元素。1、8、12三种元素分别为氢、氧、镁,对于由3种或以上元素组成化合物,一般先把其中的两种组成原子团,然后再与第三种元素结合形成化合物。书写化学式时,应将正价元素放在前面,负价元素放在后面。所以答案为Mg(OH)2。
(2)每个方块下方的数字表示相对原子质量。查表得知相对原子质量为35.45的元素是氯元素,它是非金属元素。由于氯的最外层电子数为7,比4大,在反应中易得到电子形成稳定结构。元素的化学性质与最外层电子数关系密切。氦的最外层电子数为2,它与有多个电子层的最外层为8个电子的结构一样,都属于稳定结构,或者说周期表中同一纵行中的元素化学性质都是相似的。故答案为氖和氩。
(3)元素是具有相同核电荷数(质子数)的一类原子的总称。由定义知,只要核电荷数、质子数相同,这一类原子就属于同种元素。所以不难理解,元素与元素最本质的区别在于质子数不同。
(4)氖原子的核外电子排面为第一层2个,第二层8个。阳离子是原子失去电子形成的,那该原子应该有3个电子层,且第3层上的电子数小于4,所以符合答案的有钠离子、镁离子、铝离子等。阴离子是原子得到电子形成的,那该原子应该有2个电子层,且最外层上的电子数大于4,满足要求的有氧离子、氟离子等。
考点:元素周期表,原子结构示意图,离子符号及化学式的书写等。

练习册系列答案
相关题目
钙是人体必须的常量元素,每日必须摄入足够量的钙。目前市场上的补钙药剂很多,下图是某种品牌的补钙药品的部分说明书。
| XX钙片 [药品规格] 每片含CaCO3 0.625g [用法用量] 每次一片,每天2次 |
(1)CaCO3的相对分子质量为_ __,CaCO3中碳元素和氧元素的质量比为 ,CaCO3中钙元素的质量分数为 。
(2)若每片钙片的质量为1g,则钙片中钙元素的质量分数为 。
(3)如果按用量服用,每天摄入钙元素的质量为 g。
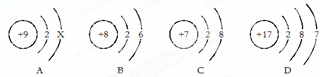
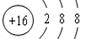
 ;④O2﹣四种符号,其含义与下列表述相一致的是(用序号填空)
;④O2﹣四种符号,其含义与下列表述相一致的是(用序号填空)