题目内容
某钙片的标签如图所示,可知此钙片成分中只有碳酸钙含有钙元素.
(1)请通过计算说明此标签中的含钙量是否错误.
(2)为测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量盐酸的烧杯中,充
分反应后再称取烧杯和剩余物的总质量.小东做了三次实验,数据如下:
(1)请通过计算说明此标签中的含钙量是否错误.
| 执行标准:GB1413-99 主要成分:碳酸钙 含钙量:每片含钙0.75g 每瓶50片,重40g (中外合资××公司出品) |
分反应后再称取烧杯和剩余物的总质量.小东做了三次实验,数据如下:
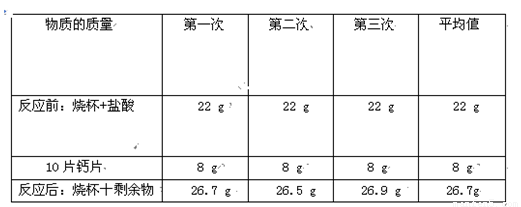
| 物质的质量 | 第一次 | 第二次 | 第三次 | 平均值 |
| 反应前:烧杯+盐酸 | 22g | 22g | 22g | 22g |
| 10片钙片 | 8g | 8g | 8g | 8g |
| 反应后:烧杯+剩余物 | 26.7g | 26.5g | 26.9g | 26.7g |
分析:(1)先计算出碳酸钙中钙元素的质量分数,再计算出每片钙片中含有钙元素的质量,与标签中的含钙量相比较,判断此标签中的含钙量是否错误;
(2)根据三次实验的平均值和质量守恒定律,反应前烧杯和反应物的质量总和-反应后烧杯和剩余物的质量即是生成二氧化碳气体的质量;然后根据碳酸钙与盐酸反应的化学方程式计算出参加反应的碳酸钙的质量(即10片钙片的质量),进而计算出每片此钙片含碳酸钙的质量.
(2)根据三次实验的平均值和质量守恒定律,反应前烧杯和反应物的质量总和-反应后烧杯和剩余物的质量即是生成二氧化碳气体的质量;然后根据碳酸钙与盐酸反应的化学方程式计算出参加反应的碳酸钙的质量(即10片钙片的质量),进而计算出每片此钙片含碳酸钙的质量.
解答:解:(1)本品若为纯碳酸钙,碳酸钙的相对分子质量为100,钙元素的质量分数为
×100%=40%,
每片含钙量为:
×40%=0.32g
因此本品每片不可能含钙0.75g,此标签中的含钙量错误.
(2)生成二氧化碳气体的质量为:22g+8g-26.7g=3.3g,
设10片钙片含碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
=
x=7.5g,
因此每片此钙片含碳酸钙的质量为7.5g÷10=0.75g.
每片此钙片的含钙量为0.75g×40%=0.3g.
答:(1)标签中的含钙量是错误的;(2)每片此钙片含钙的质量为0.3g.
| 40 |
| 100 |
每片含钙量为:
| 40g |
| 50 |
因此本品每片不可能含钙0.75g,此标签中的含钙量错误.
(2)生成二氧化碳气体的质量为:22g+8g-26.7g=3.3g,
设10片钙片含碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
| 100 |
| 44 |
| X |
| 3.3g |
因此每片此钙片含碳酸钙的质量为7.5g÷10=0.75g.
每片此钙片的含钙量为0.75g×40%=0.3g.
答:(1)标签中的含钙量是错误的;(2)每片此钙片含钙的质量为0.3g.
点评:本题难度不大,掌握有关化学式的计算、利用化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳气体的质量是正确解答本题的关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
某钙片的标签如图所示.
(1)请通过计算说明此标签中的含钙量是否错误.
(2)为测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量.小东做了三次实验,数据如下:
试计算此钙片每片含碳酸钙的质量和钙元素的含量.

(1)请通过计算说明此标签中的含钙量是否错误.
(2)为测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量.小东做了三次实验,数据如下:
| 物质的质量 | 第一次 | 第二次 | 第三次 | 平均值 |
| 反应前:烧杯+盐酸 | 22g | 22g | 22g | 22g |
| 10片钙片 | 8g | 8g | 8g | 8g |
| 反应后:烧杯十剩余物 | 26.7g | 26.5g | 26.9g | 26.7g |

 某钙片的标签如图所示,此钙片成分中只有碳酸钙含有钙元素.
某钙片的标签如图所示,此钙片成分中只有碳酸钙含有钙元素. 某钙片的标签如图所示.
某钙片的标签如图所示.