题目内容
NaOH潮解后极易与空气中的CO2反应生成Na2CO3而变质.为测定实验室一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.
请计算:
(1)反应产生的CO2的质量为______g.
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?
(3)用同浓度的硫酸,与一瓶未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.其原因是:______(从钠元素质量守恒的角度解释).
解:(1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量为200g+200g-395.6g=4.4g.故答案为:4.4
(2)根据质量守恒定律,反应物和生成物之间的量的关系,可以解决此题.
故答案为:
解:设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
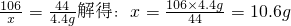
则烧碱样品中
NaOH%=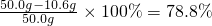
答:烧碱样品中NaOH的百分含量为78.8%.
(3)根据质量守恒定律,氢氧化钠转化成碳酸钠的过程中,钠元素的质量没变,故答案为:氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸.
分析:(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;
(2)样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得氧气的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数;
(3)根据质量守恒定律,氢氧化钠转化成碳酸钠的过程中,钠元素的质量没变,从钠元素质量守恒的角度可以解释此题.
点评:此题主要是在碱的化学性质的基础上考查有关质量守恒定律的有关知识,以及混合物中质量分数的计算问题,注重学生综合能力的培养,是中考的考点之一.
(2)根据质量守恒定律,反应物和生成物之间的量的关系,可以解决此题.
故答案为:
解:设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
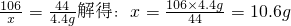
则烧碱样品中
NaOH%=
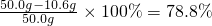
答:烧碱样品中NaOH的百分含量为78.8%.
(3)根据质量守恒定律,氢氧化钠转化成碳酸钠的过程中,钠元素的质量没变,故答案为:氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸.
分析:(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;
(2)样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得氧气的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数;
(3)根据质量守恒定律,氢氧化钠转化成碳酸钠的过程中,钠元素的质量没变,从钠元素质量守恒的角度可以解释此题.
点评:此题主要是在碱的化学性质的基础上考查有关质量守恒定律的有关知识,以及混合物中质量分数的计算问题,注重学生综合能力的培养,是中考的考点之一.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目