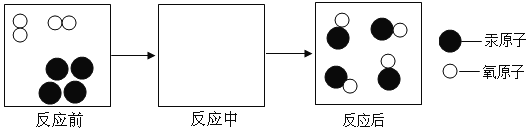
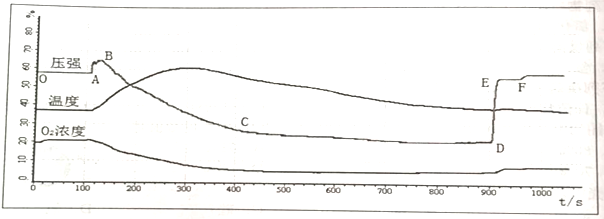
题目内容
【题目】在实验室里称取7 g含有杂质的锌放入烧杯中,向其中加入100 g一定质量分数的稀盐酸(杂质不参与反应),恰好完全反应。反应后,称量烧杯中剩余物质的总质量为106.8 g。则稀盐酸中溶质的质量分数是多少?
【答案】生成氢气的质量:7 g+100 g-106.8 g=0.2 g
设参加反应的稀盐酸中溶质的质量为x。
Zn+2HCl===ZnCl2+H2↑
73 2
x 0.2 g
![]() =
=![]() x=7.3 g
x=7.3 g
稀盐酸中溶质的质量分数为![]() ×100%=7.3%
×100%=7.3%
答:稀盐酸中溶质的质量分数为7.3%。
【解析】解:生成氢气的质量:7 g+100 g-106.8 g=0.2 g
设参加反应的稀盐酸中溶质的质量为x。
Zn+2HCl=ZnCl2+H2↑
73 2
x 0.2 g
![]()
x=7.3 g
稀盐酸中溶质的质量分数为![]() ×100%=7.3%
×100%=7.3%
答:稀盐酸中溶质的质量分数为7.3%。

练习册系列答案
相关题目