题目内容
通过海水晒制可得粗盐,粗盐除 NaCl 外,还含有 MgCl2、CaCl2、MgSO
沙等杂质。以下是制备精盐的实验方案:
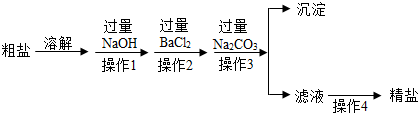
粗盐
溶解
过量
NaOH
操作 1
过量
BaCl2
操作 2
过量
Na2CO3
操作 3
沉淀
滤液
操作 4
精盐
回答下列问题:
(1)操作 1 中,加入 NaOH 溶液除杂时,反应的化学方程式为 ; 。
(2)操作 2 中,不能用硝酸钡溶液代替 BaCl2 溶液,原因是 。
(3)加入 Na2CO3 除去的杂质离子是 。
(4) 进行操作 3 后,判断 Na2CO3 过量的方法是 。
(5)滤液中,需加入适量的试剂,这种试剂的名称是 。
(6)在操作 4 中,需要进行蒸发,蒸发时需用到的仪器有铁架台(含铁圈)、酒精灯、
玻璃棒、 。
(7)若精盐的产率偏低,可能的原因是 。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.溶解粗盐时,加入的水量不足,粗盐没有完全溶解
(1)2NaOH+ MgCl2 == Mg(OH)2↓+2NaCl; MgSO4+ 2NaOH == Mg(OH)2↓+Na2SO4
(2)引入了杂质NO3— (或硝酸钡) (3)Ca2+、Ba2+
(4)取少量滤液于试管中,滴 加稀盐酸,有气泡产生
加稀盐酸,有气泡产生
(5)稀盐酸 (6)蒸发皿 (7)B、C

练习册系列答案
相关题目