题目内容
【题目】(7分)某兴趣小组的同学研究(Cu-Zn合金)样品中锌的含量,取该样品18g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如下图所示。请计算:
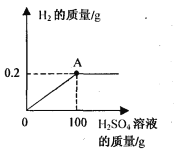
(1)该样品中锌的质量为 。
(2)所用稀硫酸的溶质质量分数(要有规范的计算过程)。
(3)图中A点时,反应后所得溶液的溶质质量分数为 。(保留1位小数)。
【答案】(1)6.5克 (2)9.8%(3)15.1%
【解析】
试题分析:首先根据氢气的质量,利用化学方程式计算出纯锌的质量、硫酸溶质的质量和硫酸锌质量,再进行相应计算即可。
解:设样品中纯锌的质量为X,稀硫酸中溶质的质量为Y,生成硫酸锌的质量为M
根据图示可知,产生氢气的质量为0.2克
Zn + H2SO4==ZnSO4 + H2↑
65 98 161 2
X Y M 0.2克
65/2=X/0.2克 X=6.5克
98/2=Y/0.2克 Y=9.8克
161/2=M/0.2克 M=16.1克
所以所用稀硫酸中溶质质量分数=9.8克/100克*100%=9.8%
所得硫酸锌溶液中溶质质量分数=16.1克/(6.5克+100克-0.2克)*100%=15.1%
答:略

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目