题目内容
在一密闭容器内有四种物质,一定条件下充分反应后,测得反应前后的质量如下表所示,下列说法不正确的是( )
| 物质 | X | Y | Z | W | Q |
| 反应前质量(g) | 10 | 16 | 1.2 | 0 | 0.2 |
| 反应后质量(g) | m | 0 | 10 | 5.6 | 11 |
| A、反应后物质m的质量为0.8g |
| B、物质Z、W、Q所含元素种类与X、Y所含元素种类相同 |
| C、该变化的基本反应类型是分解反应 |
| D、反应中Y、Z、W的质量比为20:11:7 |
考点:质量守恒定律及其应用,反应类型的判定
专题:化学用语和质量守恒定律
分析:根据质量守恒定律中的物质的总质量不变求待测物质的质量,反应后质量增加属于生成物,反应后质量减少,属于反应物,根据反应时物质的质量关系求出各物质的质量比;分解反应的特点是“一变多”.
解答:解:A、质量守恒定律中的物质的总质量不变:10g+16g+1.2g+0g+0.2g=m+0g+10g+5.6g+11g,解得:m=0.8g,正确;
B、由数据可知,X、Y的质量减小,属于反应物,Z、W、Q的质量增加,属于生成物,表达式为:X+Y→Z+W+Q,根据质量守恒定律,反应前后元素的种类不变,物质Z、W、Q所含元素种类与X、Y所含元素种类相同,故正确;
C、由B知,该反应表达式为:X+Y→Z+W+Q,不是分解反应,故错误;
D、反应中Y、Z、W的质量比为:(16g-0g):(10g-1.2g):(5.6g-0g)=20::1:7.
故选C.
B、由数据可知,X、Y的质量减小,属于反应物,Z、W、Q的质量增加,属于生成物,表达式为:X+Y→Z+W+Q,根据质量守恒定律,反应前后元素的种类不变,物质Z、W、Q所含元素种类与X、Y所含元素种类相同,故正确;
C、由B知,该反应表达式为:X+Y→Z+W+Q,不是分解反应,故错误;
D、反应中Y、Z、W的质量比为:(16g-0g):(10g-1.2g):(5.6g-0g)=20::1:7.
故选C.
点评:本题主要考查质量守恒定律中的物质总质量不变和根据反应物和生成物的判断考虑,难度稍大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
下列符号既可表示一个原子,又可表示一种元素,还能表示一种单质的是( )
| A、H |
| B、NO2 |
| C、Cu |
| D、O2 |
2013年5月31日是第25个世界无烟日.香烟烟气中含有几百种对人体有害的物质,如尼古丁(C10H14N2)等.下列关于尼古丁的说法错误的是( )
| A、属于化合物 |
| B、由碳、氢、氧三种元素组成 |
| C、每个尼古丁分子中含有3种元素 |
| D、尼古丁分子中含有氮分子 |
下列对相关实验现象的描述错误的是( )
| A、在淀粉溶液中滴加碘酒后溶液变蓝 |
| B、聚乙烯在空气中灼烧有刺激性气味 |
| C、硫在空气中燃烧产生淡蓝色火焰 |
| D、在稀硫酸中滴加紫色石蕊试液后溶液变红 |
1875年法国化学家布瓦博德朗发现了元素镓(Ga),它的原子核内质子数是31,相对原子质量是70,则它的原子核内中子数为( )
| A、31 | B、39 | C、70 | D、101 |
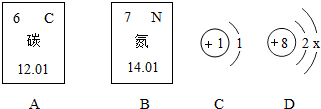
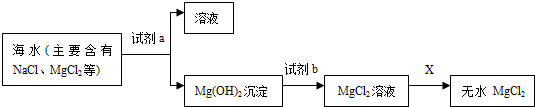
 .请回答:
.请回答: