题目内容
【题目】有一包只含有Na2CO3和NaHCO3的混合物,为了测定其含量,技术员小颖取19g样品放入烧杯中,加入100g水充分溶解后,逐滴滴入稀盐酸并不断搅拌,至B点时恰好完全反应.测出烧杯内溶液的总质量与加入稀盐酸质量的关系曲线如图所示(反应生成的气体全部逸出).
已知,Na2CO3与HCl反应分两步进行:第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应:NaHCO3+HCl=NaCl+H2O+CO2↑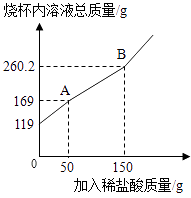
求:
(1)图中AB段表示第步反应;反应后生成的CO2质量是 g.
(2)所加入的稀盐酸中溶质质量分数是多少?
(3)样品中NaHCO3的质量是多少?
【答案】
(1)二,8.8
(2)解:设AB段稀盐酸中氯化氢的质量为x,
NaHCO3+ | HCl=NaCl+H2O+ | CO2↑ |
36.5 | 44 | |
x | 8.8g |
![]() =
= ![]() ,
,
x=7.3g,
所加入的稀盐酸中溶质质量分数为: ![]() ×100%=7.3%,
×100%=7.3%,
答:所加入的稀盐酸中溶质质量分数为7.3%
(3)解:设碳酸钠的质量为y,
Na2CO3+ | HCl=NaCl+NaHCO3, |
106 | 36.5 |
y | 50g×7.3% |
![]() =
= ![]() ,
,
y=10.6g,
样品中NaHCO3的质量为:19g﹣10.6g=8.4g,
答:样品中NaHCO3的质量为8.4g
【解析】解:(1)图中AB段质量减少了,表示第而二步反应;
反应后生成的CO2质量为:19g+100g+150g﹣260.2g=8.8g.
故答案为:二;8.8.
根据图像分析,找出已知条件,再利用方程式的计算方法,根据各物质间的质量关系,求出对应数据中对应物质的质量解答。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
