题目内容
【题目】实验室中有一包由KCl、MgSO4和CaCl2组成的固体混合物,某校研究性学习小组的同学为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计了如下实验方案。
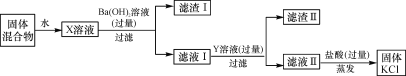
请你回答下列问题:
(1)X溶液与Ba(OH)2溶液反应的化学方程式是______________。
(2)Y溶液中溶质的化学式是_______________。
(3)该实验中盐酸的作用是_________________。
【答案】Ba(OH)2+MgSO4===BaSO4↓+Mg(OH)2↓K2CO3除去滤液Ⅱ中的KOH和多余的K2CO3
【解析】
(1)X溶液中含有硫酸镁、氯化钾、氯化钙,加入过量的氢氧化钡后,氢氧化钡可以与硫酸镁反应生成氢氧化镁沉淀和硫酸钡沉淀,反应方程式为Ba(OH)2+MgSO4===BaSO4↓+Mg(OH)2↓。
(2)原溶液中的氯化钾、氯化钙不与氢氧化钡反应,故反应过滤后溶液中的溶质有过量的氢氧化钡和没有反应的氯化钾、氯化钙,要出去溶液中钡离子和钙离子,可以加入过量的碳酸钾,化学式为K2CO3。
(3)最后的步骤中加入稀盐酸是为了与氢氧化钾和碳酸钾反应,除去杂质。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】生活中选择适当的清洗剂可以得到更好的清洗效果,根据下表完成问题。
名称 | 洗洁精 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐 |
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 |
(1)使用洗洁精清洗餐具上的油污,这是因为它具有___________的功能。
(2)以下物质可以使用洁厕灵清洗的是___________。(填字母序号)。
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
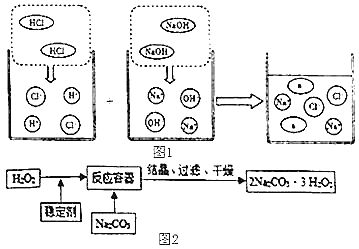
(3)若将洁厕灵与炉具清洁剂混合,可以发生如图1所示的化学反应。图中a微粒的化学式为___________。
(4)“污渍爆炸盐”的主要成分为“过碳酸”(2Na2CO33H2O2),俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如图2:
①过滤操作中使用的玻璃仪器有玻璃棒、烧杯和___________,其中玻璃棒的作用是___________。在上述流程中,向反应前的H2O2中加入稳定剂的作用是___________。
②在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是___________
A.稀硫酸
B.硫酸钠
C.二氧化锰
D.澄清石灰水