题目内容
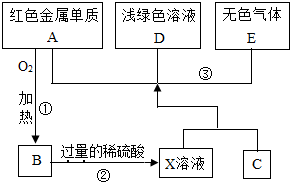 A,B,C,D,E为初中化学常见的物质,其中A,C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.
A,B,C,D,E为初中化学常见的物质,其中A,C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
(1)反应①的基本反应类型是
(2)C的化学式为
(3)写出物质E和B在加热条件下反应的化学方程式
(4)如图转化中产生无色气体E的原因是
(5)写出反应③中发生反应的化学方程式:①
②
分析:可根据物质或离子的颜色初步推断物质的成分,通过关键词,如“单质”、“过量”,来判断物质的组成或溶液中溶质的组成.
解答:解:红色物质是铜和氧化铁,A为金属单质,则A为铜;铜在加热的条件下生成氧化铜,则B为氧化铜,该反应由两种物质生成一种物质,反应类型为化合反应.
B与过量稀硫酸反应,即氧化铜与稀硫酸反应,生成硫酸铜和水;稀硫酸过量,则X溶液中有两种溶质,即生成的硫酸铜和过量的稀硫酸.
根据质量守恒定律,化学反应前后元素种类不变.由硫酸铜和稀硫酸与金属C反应生成铜、浅绿色的亚铁离子的溶液和无色气体可知,金属C能把Cu置换出来,并能与酸产生氢气,同时生成亚铁离子,固金属C为铁,浅绿色的溶液为硫酸亚铁,无色气体是氢气.
则E与B在加热条件下反应,即氢气与氧化铜在加热条件下反应,化学方程式为:H2+CuO
Cu+H2O.
无色气体E是氢气,由金属铁与稀硫酸反应产生的,稀硫酸是过程②中加入过量导致的.
③中的化学反应是铁与过量的稀硫酸反应产生氢气、铁与硫酸铜反应生成铜和硫酸亚铁,则化学方程式为:
①Fe+H2SO4=FeSO4+H2↑、②Fe+CuSO4=FeSO4+Cu
故答案为:化合反应、Fe、H2+CuO
Cu+H2O、稀硫酸过量、①Fe+H2SO4=FeSO4+H2↑、②Fe+CuSO4=FeSO4+Cu
B与过量稀硫酸反应,即氧化铜与稀硫酸反应,生成硫酸铜和水;稀硫酸过量,则X溶液中有两种溶质,即生成的硫酸铜和过量的稀硫酸.
根据质量守恒定律,化学反应前后元素种类不变.由硫酸铜和稀硫酸与金属C反应生成铜、浅绿色的亚铁离子的溶液和无色气体可知,金属C能把Cu置换出来,并能与酸产生氢气,同时生成亚铁离子,固金属C为铁,浅绿色的溶液为硫酸亚铁,无色气体是氢气.
则E与B在加热条件下反应,即氢气与氧化铜在加热条件下反应,化学方程式为:H2+CuO
| ||
无色气体E是氢气,由金属铁与稀硫酸反应产生的,稀硫酸是过程②中加入过量导致的.
③中的化学反应是铁与过量的稀硫酸反应产生氢气、铁与硫酸铜反应生成铜和硫酸亚铁,则化学方程式为:
①Fe+H2SO4=FeSO4+H2↑、②Fe+CuSO4=FeSO4+Cu
故答案为:化合反应、Fe、H2+CuO
| ||
点评:本题主要考查了反应的基本类型、物质和离子的颜色、化学方程式的书写及正确分析实验方面的内容.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
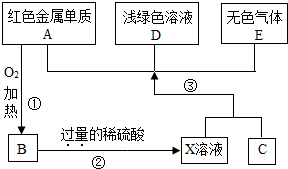 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答: 16、A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
16、A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答: