题目内容
对
100g溶质质量分数为10%的某物质的溶液,分别进行如下操作:①蒸发掉10g水;无晶体析出;②加入溶质质量分数为10%的同种溶质的溶液10g;③加入10g同种溶质,且完全溶解;④加入10g水,操作后的四种溶液的质量分数由小到大的顺序是[
]|
A .①②③④ |
B .④②①③ |
C .④③②① |
D .④②③① |
解析:
|
根据质量分数的计算公式,不难得出③最大,①次之,而②的溶质质量分数不变,④加水后溶质质量分数最小,故正确选项为 B.但有些同学,不通过计算仅靠主观分析,误认为蒸发水分后,溶质质量分数最大,加溶质且全部溶解后质量分数第二大,这样会误选D. |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(4分)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)65℃时,该溶液是否为饱和溶液?______(填“是”、“否”或“无法判断”);
(2)将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的有 _ (填序号)。
①升温 ②降温 ③加溶质M④加水 ⑤加另一种固体N⑥恒温蒸发水 ⑦与40℃时M的饱和溶液混合
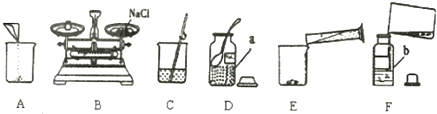
(3)20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码盒)、烧杯、______。
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
(1)65℃时,该溶液是否为饱和溶液?______(填“是”、“否”或“无法判断”);
(2)将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的有 _ (填序号)。
①升温 ②降温 ③加溶质M④加水 ⑤加另一种固体N⑥恒温蒸发水 ⑦与40℃时M的饱和溶液混合
(3)20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码盒)、烧杯、______。
(6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的_______性。
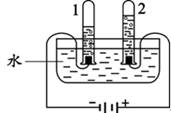
(2)根据图中实验只生成了氢气和氧气,确定水是由氢元素和氧元素组成的,得到此结论的依据是________。写出此实验中发生反应的化学方程式________。
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
|
溶液的温度/℃ |
75 |
65 |
50 |
35 |
20 |
|
析出固体M的质量/g |
0 |
0 |
2.0 |
4.5 |
8.4 |
若不考虑水蒸发对实验的影响,请回答下列问题。
① 65℃时,该溶液是否为饱和溶液? (填“是”、“否”或“无法判断”);
② 将t℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的是 (填字母序号);
A. 升温 B. 降温 C. 加溶质M
D. 加水 E. 加另一种固体N F. 恒温蒸发水
G. 与t℃时M的饱和溶液混合
③ 20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码)、烧杯、 。
实验室制取二氧化碳的实验探究.
反应物的形状大小和浓度会影响化学反应速率,下面对实验室制取二氧化碳的药品进行探究:
(1)配制不同溶质质量分数的盐酸.
实验室用36%的浓盐酸配制成100g溶质质量分数为14%的稀盐酸,需要加入水的质量为______g(精确1g);在浓盐酸稀释过程中需要用到的仪器有:量筒、胶头滴管、______;
(2)用不同溶质质量分数的盐酸溶液分别和碳酸钙粉末、大理石颗粒反应,实验记录如下:
| 实验编号 | 盐酸的质量分数 | CaCO3固体(1g) | 反应时间 | 实验现象 |
| 1 | 36% | 粉末 | 6秒 | 反应迅速,并产生大量气泡 |
| 2 | 28% | 粉末 | 8秒 | 反应迅速,并产生大量气泡 |
| 3 | 14% | 粉末 | 12秒 | 反应迅速,并产生大量气泡,有固体剩余 |
| 4 | 36% | 颗粒 | 3分25秒 | 产生大量气泡,伴有泡沫产生 |
| 5 | 28% | 颗粒 | 6分钟 | 产生大量气泡,伴有泡沫产生 |
| 6 | 14% | 颗粒 | 14分钟 | 产生大量气泡,伴有泡沫产生,有固体剩余 |
______;______;
②为了顺利完成实验室制取二氧化碳的实验,你认为可选取的实验方案______(填一实验编号),该反应化学方程式是______;
(3)图中可用于制取、收集二氧化碳的装置是______(填字母).