题目内容
【题目】现有含金属元素的质量分数为75%的氧化铁和氧化铜组成的混合物6.4g,与200g硫酸溶液恰好完全反应,则所用硫酸溶液的溶质质量分数为( )
A. 9.8% B. 4.9% C. 19.6% D. 10%
【答案】B
【解析】
根据氧化铁和稀硫酸反应生成硫酸铁和水,氧化铜和稀硫酸反应生成硫酸铜和水,再根据氧元素的质量守恒进行分析解答。
由于氧化铁和氧化铜的混合物与200g硫酸溶液恰好完全反应,分析化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,CuO+H2SO4=CuSO4+H2O可知,氧化物中氧元素全部转变为水中的氧元素,生成水中氢元素全部来自硫酸;氧化铁、氧化铜组成的混合物中氧元素的质量=6.4g×(1-75%)=1.6g,设:硫酸溶液中硫酸的质量为x,由化学方程式可以得到氧化铁、氧化铜组成的混合物中氧元素、水、硫酸的关系如下:
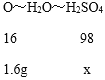
![]() x=9.8g
x=9.8g
则该硫酸溶液中氢元素的质量分数=![]() =4.9%。故选B。
=4.9%。故选B。

【题目】物质的组成、分类及表示是学习化学的基础
(1)地壳中最多的元素是 _________。
(2)世界上的物质都是由粒子构成的,仿照示例填空
物质名称 | 示例:水 | 铁 | ____ | 氯化钠 |
构成物质的粒子 | 分子 | ____ | 分子 | _____ |
(3)下图A、B、C表示气体分子示意模型,其中共包含_________种原子,属于混合物的是____________(填字母,下同)。

【题目】(1)分类是学习化学常用的方法。
初中化学有许多实验,有的实验侧重于观察和描述,属于观察和描述型实验;有的实验侧重于对一个问题采用控制变量的方法系统探究,属于问题探究型实验。据此可将实验B与实验①_____归为一类。分类的依据是:②___________________________。
蜡烛及其燃烧的探究 |
探究可燃物燃烧的条件 |
酸、碱与指示剂作用 |
铁制品锈蚀的条件 |
A | B | C | D |
(2)在九年化学书附录I部分,酸、碱、盐的溶解性表中,有些物质溶解性用“—”表示,说明该物质不存在或遇到水就会发生“水解”反应。
例如碳酸铝遇水就会发生“水解”反应:Al 2(CO3)3+ 3H2O==2Al(OH)3↓ + 3CO2↑,据此信息请同学们写出碳酸铁(其中铁元素的化合价与碳酸铝中铝元素的化合价相同)“水解”反应的化学方程式①____________________________,反应过程中观察到的实验现象有②__________________________(答两点)。
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()