题目内容
【题目】向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示.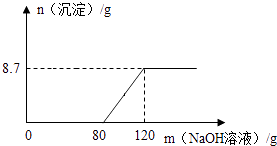
(1)计算氢氧化钠溶液的溶质质量分数
(2)氢氧化钠溶液反应所消耗硫酸溶质的质量为多少克.
【答案】
(1)解:生成8.7gMg(OH)2消耗的NaOH的质量为x,氢氧化钠溶液反应所消耗硫酸溶质的质量为y,
MgSO4+ | 2NaOH= | Mg(OH)2↓+Na2SO4 |
80 | 58 | |
x | 8.7g |
![]() =
= ![]() ,
,
x=12g,
氢氧化钠溶液中溶质质量分数为: ![]() ×100%=30%,
×100%=30%,
答:氢氧化钠溶液中溶质质量分数为30%
(2)解:H2SO4消耗的NaOH的质量为:80g×30%=24g,
H2SO4+ | 2NaOH=Na2SO4+2H2O |
98 | 80 |
y | 24g |
![]() =
= ![]() ,
,
y=29.4g,
答:氢氧化钠溶液反应所消耗硫酸溶质的质量为29.4g.
【解析】本题主要考察物质之间的计算。
故答案为:解:生成8.7gMg(OH)2消耗的NaOH的质量为x,氢氧化钠溶液反应所消耗硫酸溶质的质量为y,
MgSO4+ | 2NaOH= | Mg(OH)2↓+Na2SO4 |
80 | 58 | |
x | 8.7g |
![]() =
= ![]() ,
,
x=12g,
氢氧化钠溶液中溶质质量分数为: ![]() ×100%=30%,
×100%=30%,
答:氢氧化钠溶液中溶质质量分数为30%。
解:H2SO4消耗的NaOH的质量为:80g×30%=24g,
H2SO4+ | 2NaOH=Na2SO4+2H2O |
98 | 80 |
y | 24g |
![]() =
= ![]() ,
,
y=29.4g,
答:氢氧化钠溶液反应所消耗硫酸溶质的质量为29.4g。
本题主要考察依据化学方程式的计算,即参加反应的物质质量之比等于相对分子质量乘以化学计量数之比。

练习册系列答案
相关题目