题目内容
【题目】有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠、氢氧化钠中的一种或几种组成.为了探究该固体的组成,某化学小组设计并开展以下实验:
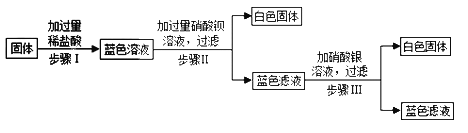
已知,步骤Ⅰ中固体全部消失,溶液呈蓝色.有气泡产生.步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成.请回答下列问题:
(1)原固体中一定含有的物质是_______________.依据是_________________.
(2)步骤II中产生白色沉淀的化学方程式是_____________________________.
(3)步骤Ⅲ所得蓝色滤液中一定含有的溶质是____________________________.
【答案】 Cu(NO3)2、NaHCO3、Na2SO4 固体加过量稀盐酸,溶液呈蓝色,有气泡产生,步骤Ⅱ加入过量硝酸钡产生白色沉淀 Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3 Cu(NO3)2、NaNO3、Ba(NO3)2、HNO3
【解析】根据固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜;又因为有气泡产生,所以固体中一定含有碳酸氢钠;步骤Ⅱ加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠;步骤Ⅲ中加入硝酸银溶液,出现白色沉淀,则该白色沉淀为氯化银,由于一开始加入过量稀盐酸,所以溶液中一定有氯离子,所以会生成氯化银沉淀,但不能确定一定含有氯化钠。
解:(1)原固体中一定含有的物质是Cu(NO3)2 、NaHCO3、Na2SO4;固体加过量稀盐酸,溶液呈蓝色,有气泡产生,步骤Ⅱ加入过量硝酸钡产生白色沉淀;
(2)硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,化学方程式是Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3;
(3)根据向固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜溶于水,所以蓝色滤液中一定含有硝酸铜和硝酸;加入过量硝酸钡,说明硝酸钡有剩余,所以蓝色滤液中一定含有硝酸钡;硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,所以蓝色滤液中一定含有硝酸钠。故步骤Ⅲ所得蓝色滤液中一定含有的溶质是Cu(NO3)2、NaNO3、Ba(NO3)2、HNO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案