题目内容
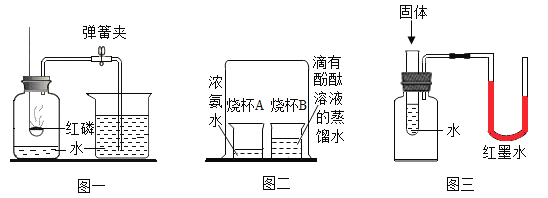
【题目】请根据如图所示实验,回答问题。
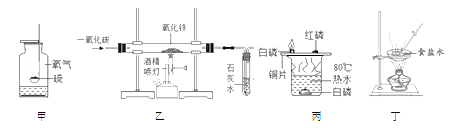
(1)甲瓶中硫燃烧的现象________,集气瓶预留了少量水,其作用是________。
(2)乙中玻璃管中的现象是_______,该装置的不足之处是________。
(3)丙中铜片上的白磷燃烧,红磷不燃烧,由此可得可燃物燃烧的条件是________。
(4)丁图中玻璃棒搅拌的目的是________。
【答案】发出蓝紫色火焰,生成有刺激性气味的气体,放热 吸收二氧化硫,防止污染空气 红棕色粉末变黑 没有尾气处理装置 温度达到可燃物的着火点 防止因局部温度过高,造成液滴飞溅
【解析】
(1)甲瓶中硫燃烧的现象是:发出蓝紫色火焰,生成有刺激性气味的气体,放出热量;因为生成物二氧化硫污染空气,二氧化硫又能溶于水,所以集气瓶预留了少量水,其作用是:吸收二氧化硫,防止污染空气。
(2)乙中玻璃管中发生的是一氧化碳和氧化铁反应,反应生成铁和二氧化碳,现象是:红棕色粉末变黑;实验中一氧化碳不能全部参与反应,如果直接排放到空气中就会污染空气,因此该装置的不足之处是:没有尾气处理装置。
(3)丙中铜片上白磷和红磷都与氧气接触,但白磷燃烧,红磷不燃烧,由此可得可燃物燃烧的条件是:可燃物的温度必须达到可燃物的着火点。
(4)蒸发操作中如果不用玻璃棒搅拌,蒸发皿内液体就可能受热不均匀,造成液滴飞溅,因此丁图中玻璃棒搅拌的目的是:防止因局部温度过高,造成液滴飞溅。

【题目】为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
氢氧化钠溶液质量/g | 40 | 40 | 40 | 40 | 40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
试分析计算。
(1)m的值为_____。
(2)固体混合物中硫酸镁的质量分数。_____(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。_____