题目内容
【题目】请根据硝酸铵(NH4NO3)的化学式进行计算:
(1)氮、氢、氧三种元素的质量比_______;
(2)硝酸铵中氮元素的质量分数________;
(3)已知硝酸铵样品中氮元素的质量分数28%(杂质不含N),则样品中硝酸铵的质量分数为___________。
(4)计算_________克的硝酸铵与30g尿素(CO(NH2)2)的含氮量相等?(写出计算过程)。
【答案】7:1:12 35% 80% 40
【解析】
(1)硝酸铵中氮、氢、氧元素的质量比为(14×2):(1×4):(16×3)=7:1:12。
(2)硝酸铵中氮元素的质量分数是![]() ×100%=35%。
×100%=35%。
(3)则该样品中硝酸铵的纯度为:28%÷35%=80%。
(4)设硝酸铵质量为x时和30g尿素的含氮量相等,则
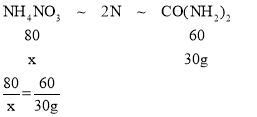
解得:x=40g
答案为:(1)7:1:12;(2)35%;(3)80%;(4)40g。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
【题目】小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。请计算:
第一次 | 第二次 | 第三次 | 第四次 | |
加入澄清石灰水的质量/g | 100 | 100 | 100 | 100 |
生成沉淀的质量/g | 0.4 | m | 1.0 | 1.0 |
(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。