题目内容
【题目】如图1是小明在20℃时进行的系列实验示意图,①﹣⑤表示实验所得溶液;图2是NaCl、KNO3的溶解度曲线. 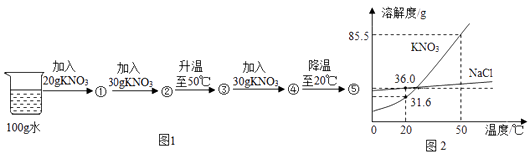
(1)20℃时,KNO3的溶解度(S)=;⑤是(填“饱和”或“不饱和”)溶液.
(2)50℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1(填“>”“=”或“<”)w2 .
(3)小明发现:升温至50℃,②→③的过程中有少量水蒸发,下列叙述正确的是(填序号) a.①、②均为不饱和溶液
b.②→③的过程中溶质质量分数变大
c.④→⑤的过程中析出KNO3晶体53.9g
(4)除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→→过滤→洗涤→干燥→KNO3 .
【答案】
(1)31.6g;饱和
(2)<
(3)b
(4)降温结晶
【解析】解:(1)通过分析溶解度曲线可知,20℃时,KNO3的溶解度为 31.6g;20℃时的溶液⑤中含100水和20g+30g+30g=80g的硝酸钾,由于该温度下硝酸钾的溶解度是31.6g,即溶液⑤是饱和溶液;(2)50℃时,硝酸钾的溶解度大于氯化钠的溶解度,即该温度下100g水中溶解硝酸钾的最大量大于溶解氯化钠的最大量,所以饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1<w2;(3)a、20℃时,KNO3的溶解度为 31.6g,此时100g水中溶解20g硝酸钾形成不饱和溶液①,继续加入30g的硝酸钾后形成饱和溶液②并剩余固体18.4g,故a错误;
b、②→③的过程中溶液温度升高,硝酸钾的溶解度由31.6g→85.5g,则②剩余的18.4g固体全部溶解,溶液溶质质量分数变大,故b正确;
c、溶液④温度为50℃,溶剂量100g,硝酸钾固体质量80g,溶解度是85.5g,所以溶液④是不饱和溶液,溶液⑤温度为20℃,溶剂量100g,溶解度是31.6g,所以溶液④是饱和溶液,④→⑤的过程中析出KNO3晶体80g﹣31.6g=48.4g,故c错误;
故选:b;(4)硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→降温结晶→过滤→洗涤→干燥→KNO3.
所以答案是:(1)31.6g,饱和;(2)<;(3)b;(4)降温结晶.
【考点精析】认真审题,首先需要了解结晶的原理、方法及其应用(结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3)),还要掌握饱和溶液和不饱和溶液(饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解)的相关知识才是答题的关键.


