题目内容
复分解反应探究的是酸、碱、盐等化合物在溶液中相互反应的情况。回答下列问题:
书写方程式:
①氢氧化钠溶液与稀盐酸混合:____________________________________________;
②碳酸钠溶液与足量稀盐酸混合:__________________________________________;
上述反应的微观图解如右图所示:
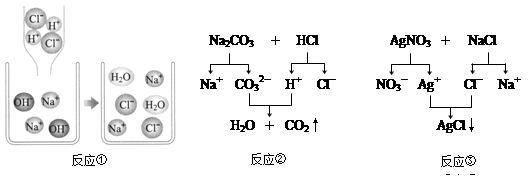
反应①的实质是H+和OH-结合生成水,Cl-和Na+没有发生变化;反应②的实质是H+和CO32-结合生成水和二氧化碳,Cl-和Na+没有发生变化,则反应③的实质是_________和__________生成AgCl。所以复分解反应的实质是某些阴、阳离子结合生成水或气体或____________的过程;
构建短线相连的下列离子对,在方框内填写相应的离子符号,要求构成的离子对能符合复分解反应的实质。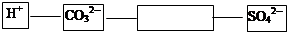
书写方程式:
①氢氧化钠溶液与稀盐酸混合:____________________________________________;
②碳酸钠溶液与足量稀盐酸混合:__________________________________________;
上述反应的微观图解如右图所示:
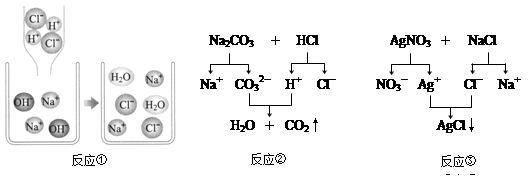
反应①的实质是H+和OH-结合生成水,Cl-和Na+没有发生变化;反应②的实质是H+和CO32-结合生成水和二氧化碳,Cl-和Na+没有发生变化,则反应③的实质是_________和__________生成AgCl。所以复分解反应的实质是某些阴、阳离子结合生成水或气体或____________的过程;
构建短线相连的下列离子对,在方框内填写相应的离子符号,要求构成的离子对能符合复分解反应的实质。

(1) ①NaOH + HCl =" NaCl" + H2O (1分)
②Na2CO3 + 2HCl =" 2NaCl" + CO2↑+ H2O (1分)
(2) Ag+和Cl-(全对1分) 沉淀(1分)
(3) Ba2+ (1分)
②Na2CO3 + 2HCl =" 2NaCl" + CO2↑+ H2O (1分)
(2) Ag+和Cl-(全对1分) 沉淀(1分)
(3) Ba2+ (1分)
试题分析:(1)①氢氧化钠是碱,稀盐酸是酸,二者能发生中和反应,生成氯化钠和水,故反应的化学方程式为NaOH + HCl =" NaCl" + H2O;
②碳酸钠溶液能与稀盐酸反应,生成氯化钠、水和二氧化碳,故反应的化学方程式为Na2CO3 + 2HCl =" 2NaCl" + CO2↑+ H2O。
(2)根据题意,反应①的实质是H+和OH-结合生成水;反应②的实质是H+和CO32-结合生成水和二氧化碳;再结合复分解反应发生的条件,即反应物相互交换成分后,要至少能生成水、气体或沉淀中的一种,可知复分解反应的实质就是构成反应物的离子相互结合生成水、气体或沉淀中的一种,故反应③的实质是Ag+和Cl-生成AgCl沉淀。
(3)根据上面的分析可知,短线相连的阴、阳离子能两两结合生成沉淀或气体或水,而能同时与CO32-和SO42-结合的只能是Ba2+,因为Ba2+均能与这二者产生沉淀。
点评:复分解反应的实质就是溶液中离子间的反应,溶液中离子间能形成沉淀或气体或水(至少之一),复分解反应就能发生。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目