题目内容
(2013广东佛山)A、B、C、D、E是初中化学常见物质,转化关系如图(其中部分生成物和反应条件已略):已知B是黑色固体,相对分子质量为80,E是然气的主要成份,请回答下列问题:
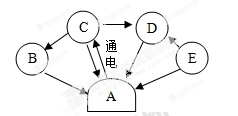
(1)B是______,E是_____(均填化学式)。
(2)A→C的化学方程式为_________________________;
E→D的化学方程式为_________________________;
若B→A是复分解反应,化学方程式为_________________________;
(3)已知:Cu2O是红色固体,难溶于水,与稀硫酸反应的化学方程式如下:Cu2O+H2SO4=Cu+CuSO4+H2O若B→A是置换反应,在发生置换过程可能发生副反应生成Cu2O,产生为红色固体,其产物组合可能有____种,小思同学称取14.4g产物与足量的稀硫酸充分反应后,经过滤,洗涤、干燥,得到固体8.6g,则产物的成分为 ______________。

(1)B是______,E是_____(均填化学式)。
(2)A→C的化学方程式为_________________________;
E→D的化学方程式为_________________________;
若B→A是复分解反应,化学方程式为_________________________;
(3)已知:Cu2O是红色固体,难溶于水,与稀硫酸反应的化学方程式如下:Cu2O+H2SO4=Cu+CuSO4+H2O若B→A是置换反应,在发生置换过程可能发生副反应生成Cu2O,产生为红色固体,其产物组合可能有____种,小思同学称取14.4g产物与足量的稀硫酸充分反应后,经过滤,洗涤、干燥,得到固体8.6g,则产物的成分为 ______________。
⑴ CuO CH4 (2) 2H2O通电 2H2↑+O2↑: CH4 +2O2点燃 CO2 +2H2O
CuO+2HCl=CuCl2+H2O(补充答案 CuO+H2SO4=CuSO4+H2O (3) 二 Cu、 Cu2O
CuO+2HCl=CuCl2+H2O(补充答案 CuO+H2SO4=CuSO4+H2O (3) 二 Cu、 Cu2O
试题分析:已知B是黒色固体、相对分子质量为80,从所学的黑色固体主要有碳、氧化铜、二氧化锰等,而这些物质中相对分子质量为80的只有氧化铜,E是天然气的主要成份,所以E是甲烷, A通电能够分解,则A是水,B能够由C制得且C是水的分解产物,所以C是氧气,D是甲烷反应的产物,所以D是二氧化碳(可由甲烷的燃烧制得也可由碳和氧气反应制得);
(1)由分析知B是CuO,E是CH4 (2)A→C是水的电解过程,该反应的化学方程式为22H2O通电 2H2↑+O2↑; E→D是甲烷燃烧的过程,化学方程式为以CH4 +2O2点燃 CO2 +2H2O,B→A属复分解反应时生成水,则该反应是氧化铜和稀酸的反应,化学方程式可以是CuO+H2SO4=CuSO4+H2O;
(3)若B→A属罝换反应,则该反应可能是氢气和氧化硐的反应,产物的固体是红色的铜,由于在发生置换过程可能发生副反应产生Cu2O,产物为红色固体,所以产物的固体可能是铜或氧化亚铜或两者的混合物,故其产物组合可能有三种,由于氧化铜和硫酸反应后固体能够完全溶解,所以小思同学称取14.4g产物与足量稀硫酸充分反应后,经过滤、干燥,得到8.6g固体能说明该固体中一定含有氧化亚铜,假设14.4g固体全部是氧化亚铜,则设该反应生成铜的质量是X
Cu2O + H2SO4 =" Cu" + CuSO4 + H2O
144 64
14.4g X
 =
= 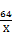
解得x=6.4g
由生成的固体质量是8.6g可知该产物中一定含有铜和氧化亚铜两种

练习册系列答案
相关题目