题目内容
【题目】(8分)完成下列研究性学习的有关内容;探究氯酸钾和二氧化锰混合物中二氧化锰的质量分数。(计算结果保留到0.01%)
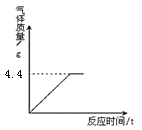
[研究方案]先称取一定质量的氯酸钾和二氧化锰混合物,放入大试管中加热至质量不再变化为止。根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量。(学习小组同学事先查阅资料获知,二氧化锰的质量在反应前后不变且在水中难溶)
(1)[解决问题]实验测得固体混合物质量随加热时间变化的相关数据如图所示。请你完成下列问题:
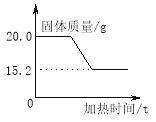
①反应后生成氧气的质量是 ;
②原混合物中氯酸钾的质量是 ;
③原混合物中二氧化锰的质量分数是 。
(2)[继续研究]为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入92.55g水使其中的氯化钾完全溶解,然后过滤使二氧化锰与溶液分离。请你计算他们得到的滤液中氯化钾的质量分数。(过滤中水的损失不计)。
【答案】(1)①4.8g ②12.25g ③38.75% (2)7.45%
【解析】
试题分析:(1)①根据质量守恒定律可知,减少的质量即为产生氧气的质量。②根据氧气的质量利用化学方程式进行计算,即可得出原混合物中氯酸钾的质量。③根据混合物质量减去氯酸钾质量即为二氧化锰质量,再用二氧化锰的质量除以原混合物质量即为原混合物中二氧化锰的质量分数。
(2)根据氧气质量可知生成氯化钾质量,再用氯化钾质量除以氯化钾溶液的质量即为滤液中氯化钾的质量分数。解:设生成氯化钾的质量为x。
2KClO3 ![]() 2KCl + 3O2↑ …………………………………………1分
2KCl + 3O2↑ …………………………………………1分
149 96
X 4.8g……………………………………………1分
![]() =
=![]() x=7.45g……………………………………………1分
x=7.45g……………………………………………1分
滤液中氯化钾的质量分数为:![]() =7.45%…………2分
=7.45%…………2分
答:略。