题目内容
【题目】某实验小组为检验露置在空气中的NaOH固体是否变质并确定其组成,开展了一下探究活动.
【讨论与交流】
(1)NaOH能与空气中的 (填化学式)发生反应生成Na2CO3.
(2)Na2CO3的水溶液呈碱性.
【查阅资料】
(3)NaOH在空气中不会转化成NaHCO3;
(4)CaCl2、NaCl的水溶液均呈中性.
【猜想假设】猜想一:固体全部为NaOH.
猜想一:固体全部为 .
猜想一:固体为NaOH和Na2CO3的混合物.
【实验探究】将待检固体溶于水配成溶液.按以下两种方案进行实验:
方案一:用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH (填“>”、“<”或“=”),说明猜想一成立.、
方案二:取该溶液少许,往其中加入足量CaCl2溶液,有白色沉淀产生;待沉淀不再产生,过滤,再往滤液中滴入酚酞试液,溶液变成 色,说明猜想三成立.
【归纳与总结】很明显,方案一的结论 (填“正确”或“错误”),理由是 .
【探究与拓展】为进一步确定原固体的组成,该实验小组的同学称取26.6g待检固体,按如图所示过程实验(步骤②产生的气体全部逸出),请参照图中提供的数据计算:
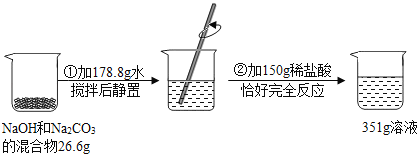
(5)26.6g固体混合物中Na2CO3的质量.
(6)所用稀盐酸中溶质的质量分数.
(7)实验最终所得351g溶液中溶质的质量分数.
【答案】CO2;Na2CO3; >;红;错误;Na2CO3溶液也呈碱性;10.6;14.6%;10%
【解析】【讨论与交流】NaOH的变质原因是吸收了空气中的CO2,生成了Na2CO3;
【猜想假设】氢氧化钠可能没有变质,固体全部为NaOH;氢氧化钠可能部分变质,固体为NaOH和Na2CO3的混合物;因此也可能是氢氧化钠完全变质,固体为Na2CO3;
【实验探究】方案一:猜想一固体全部为NaOH若成立,则溶液呈现碱性,所以测定的溶液的pH>7;
方案二:由于氢氧化钠溶液和碳酸钠溶液都呈碱性,因此先用氯化钙溶液除去碳酸钠,再用酚酞试液变成红色证明氢氧化钠的存在,猜想三成立;
【归纳与总结】由于碳酸钠溶液也呈碱性无法判断判断猜想一是否成立,因此方案一的结论错误;
【探究与拓展】根据质量守恒定律反应前后的质量差就是生成CO2的质量:26.6g+178.8g+150g﹣351g=4.4g
设26.6g固体混合物中Na2CO3的质量为x,反应需要氯化氢的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4g
![]() =
=![]() x=10.6g
x=10.6g
![]() =
=![]() y=7.3g
y=7.3g
![]() =
=![]() z=11.7g
z=11.7g
26.6g混合物中含有氢氧化钠的质量为:26.6g﹣10.6g=16g
则16g氢氧化钠完全反应需要氯化氢的质量为a,生成氯化钠的质量为b
NaOH+HCl=NaCl+H2O
40 36.5 58.5
16g a b
![]() =
=![]() a=14.6g
a=14.6g
![]() =
=![]() b=23.4g
b=23.4g
∴所用稀盐酸中溶质的质量分数=![]() ×100%=14.6%
×100%=14.6%
实验最终所得351g溶液中氯化钠的质量分数=![]() ×100%=10%
×100%=10%
答:26.6g固体混合物中Na2CO3的质量为10.6g;所用稀盐酸中溶质的质量分数为14.6%;所得351g溶液中氯化钠的质量分数10%