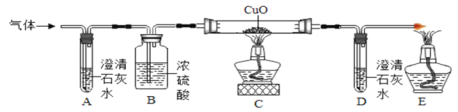
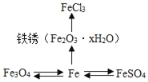
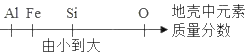
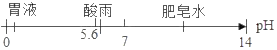题目内容
【题目】同学们在初中化学实验室中,发现一瓶如图所示久置的无色溶液,瓶口有白色固体、瓶塞丢失,已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定原溶液成分,同学们进行了如下探究:
![]()
(1)小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是_____。他取少量待测液于试管中,加入过量的稀HCl,看到_____,由此小张同学认为该溶液为Na2CO3溶液。
(2)小李同学对小张同学的结论提出疑问,由此进行了以下实验:取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,该反应方程式为_____,静置,(写出还需进行的操作及现象)_____。
通过实验,小李认为小张结论正确。
二位同学给试剂瓶贴一新标签:Na2CO3。
(3)实验结束后,同学们通过讨论认为试剂瓶原标签仍有可能不是Na2CO3,你猜测他们认为该试剂瓶原标签上的化学式可能是_____;你的理由是_____。
【答案】不是氯化钠溶液 产生气泡 Na2CO3+CaCl2═CaCO3↓+2NaCl 向溶液中滴加酚酞试液,溶液不变色 NaOH 氢氧化钠溶液完全变质后变成碳酸钠溶液
【解析】
氯化钠溶液显中性,pH=7;
氢氧化钠和二氧化碳反应生成碳酸钠和水,氢氧化钠和碳酸钠溶液都是显碱性溶液,都能使酚酞试液变红色,pH都大于7;
碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,和稀盐酸反应生成氯化钠、水和二氧化碳。
(1)小张同学取待测液测得pH=10,说明溶液不是氯化钠溶液;
他取少量待测液于试管中,加入过量的稀HCl,看到产生气泡,是因为碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,由此小张同学认为该溶液为Na2CO3溶液。
故填:不是氯化钠溶液;产生气泡。
(2)取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,是因为氯化钙和碳酸钠反应生成碳酸钙和氯化钠,该反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
静置,向溶液中滴加酚酞试液,溶液不变色。
故填:Na2CO3+CaCl2═CaCO3↓+2NaCl;向溶液中滴加酚酞试液,溶液不变色。
(3)认为该试剂瓶原标签上的化学式可能是NaOH,这是因为氢氧化钠溶液完全变质后变成碳酸钠溶液。
故填:NaOH;氢氧化钠溶液完全变质后变成碳酸钠溶液。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】小明同学欲通过实验证明二氧化锰是氯酸钾受热分解的催化剂.他设计并完成了下表所示的探究实验
实验操作 | 实验现象 | 实验结论或总结 | ||
实验结论 | 实验总结 | |||
实验一 | 氯酸钾在试管中加热, ①融化前伸入带火星的木条; ②融化后继续加热,再伸入带火星的木条, | ①木条不复燃 ②木条复燃 | 氯酸钾加热产生氧气反应的化学方程式为:________________ | 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条, | 木条不复燃 | 二氧化锰受热不产生氧气. | |
实验三 | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | ||
(1)请你帮小明同学填写上表中未填完的空格;
(2)实验一中①②说明了什么?_____.
(3)在小明的探究实验中,实验一和实验二的作用是_____.
(4)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个探究实验,最终通过实验,完整地证明了二氧化锰是氯酸钾受热分解的催化剂.第一个的实验操作中包含了两次称量,其目的是:_____;第二个的实验是要_____.
【题目】现有25g石灰石样品,请按下面要求计算
(1)25g样品与足量的稀盐酸反应放出8.8gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少?_____
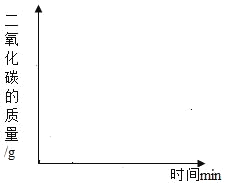
(2)若将25g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图象上画出块状样品和粉末状与稀盐酸反应放出CO2的曲线示意图。_____
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是_____(填化学式)