题目内容
【题目】下列实验设计或操作,不能达到目的的是
A.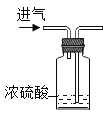 干燥气体
干燥气体
B. 验证Zn、Fe、Cu的金属活动性强弱
验证Zn、Fe、Cu的金属活动性强弱
C.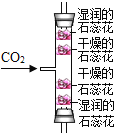 探究CO2的密度和石蕊纸花变红的原因
探究CO2的密度和石蕊纸花变红的原因
D.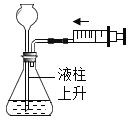 检查气密性
检查气密性
【答案】A
【解析】
A、用浓硫酸干燥一氧化碳气体,气体应该从长管进气,使气体与浓硫酸充分接触,吸收水分,不能从短管进气,气体会把浓硫酸压出来,不能达到实验目的,符合题意;
B、验证Zn、Fe、Cu的金属活动性强弱,把锌片放入硫酸亚铁溶液中,锌能置换铁,证明锌的活动性比铁的活动性强,把铜片放入硫酸亚铁溶液中,铜不能置换铁,证明铁的活动性比铜的活动性强,可以达到实验目的,不符合题意;
C、干燥的纸花不变色,湿润的纸花变红色,说明二氧化碳与水反应生成酸,酸使石蕊变红色,下层湿润的纸花比上层湿润的纸花先变红色,说明二氧化碳的密度比空气的大,可以达到实验目的,不符合题意;
D、检查气密性,推动注射器,长颈漏斗内液面上升,说明气密性良好,可以达到实验目的,不符合题意。故选A。

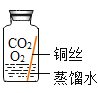
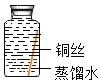
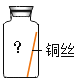
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜生锈的条件和铜锈的成分。
[提出猜想]根据空气的成分推测,铜生锈可能与CO2、H2O和O2有关。
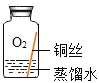
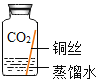
[进行实验]实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表而有绿色物质 | 无明显现象 | 无明显现象 |
[解释与结论]
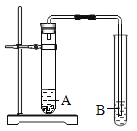
(1)猜想与假设时,同学们认为铜生锈与N2无关,其理由是_____________。
(2)依据___________(填序号)两个实验可以得出“铜生锈一定与O2有关”的结论。
(3)为验证猜想,图中实验⑤中应选取的物质是________________。
(4)由上述实验可推知,铜生锈的条件是_______________。
(5)同学们用如图所示装置检验出铜制品表面的绿色物质中含有碳酸盐,则A 中的溶液是_____________,现象为_________________,B中的现象为________________。
【题目】老师在分析金属和盐溶液反应时指出在金属活动性的顺序里,位于前面的金属能把排在后面的金属从它们的盐溶液中置换出来,但钾、钙、钠除外。李明同学很好奇,于是做了钠与硫酸铜溶液反应的实验。
(进行试验)
一块4.6g的金属钠,放入盛有一定量硫酸铜溶液的烧杯中,发现金属钠浮在液面上不停打转,产生大量气体,烧杯发烫,溶液中出现了蓝色絮状沉淀,并没有出现紫红色的铜,一会儿,部分沉淀逐渐变黑。充分反应后,冷却过滤,得到滤液是无色。
(提出问题)
金属钠与硫酸铜溶液反应后的产物是什么?无色滤液的成分是什么?
(查阅资料)
(1)①钠能与水反应生成一种碱,同时放出气体。
②氢氧化铜受热至60℃ ~80℃变暗,温度过高时分解为相应的金属氧化物和水。
(实验探究1)探究生成的气体是什么?
李明同学将上述实验药品放入锥形瓶中,立即塞上带导管的单孔塞,将导管通入肥皂水中,将燃着的木条靠近飘起的肥皂泡,有爆鸣声。说明生成的气体是____________。
(实验探究2)探究沉淀的成分是什么?
(猜想与假设)沉淀中有Cu(OH)2和CuO,还可能含有Cu。
(实验验证)
实验步骤 | 实验现象 | 结论 |
将锥形瓶内反应后过滤所得滤渣放入烧杯内,并加入足量的______ | _________ | 沉淀中没有Cu |
(实验结论)
通过实验,李明同学得出结论:钠加入硫酸铜溶液会先与水反应,生成的碱再与硫酸铜反应生成氢氧化铜。写出生成的碱与硫酸铜反应的化学方程式______________。
(实验探究3)滤液的成分是什么?
通过分析,李明同学得出:所得的无色滤液中一定含有硫酸钠,还可能含有______________。
若要证明是否含有该物质,只需向无色滤液中滴加______________ (填物质名称)观察现象即可获得结论。
(反思与交流)
(1)出现黑色物质的可能原因是______________。
(2)设计一个简单实验证明硫酸铜溶液显蓝色是由Cu2+引起的。你的方案是______________。(要求写出实验步骤和现象)
(3)钠完全反成后,所得无色滤液中硫酸钠的质量若用a表示,则a的取值范围是______________。