��Ŀ����
����Ŀ��ij��ȤС����������ʵ��װ�ã���չO2��CO2��ʵ������ȡ���й����ʵ��о���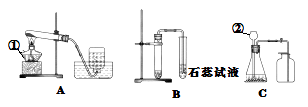
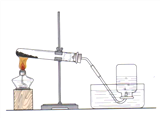
��1��д��A��Cװ�ñ�����������ƣ� ��������
��2����ͬѧ��ϡ����ʹ���ʯ��Bװ���з�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ �� �۲쵽�Թ�����ɫʯ����Һ��������
��3����ͬѧҪ��KMnO4��������ȡO2 �� Ӧѡ����ͼ�е�װ�ã�����ĸ�����÷�Ӧ�Ļ�ѧ����ʽΪ������ɡ���������ȡ�����ʡ��Ļ���ʵ�����������������ڲ�ͬŨ�ȵ�������ȼ�������̽������Ҫ�ϼ��ػ����ƿ��ͬŨ�ȵ�������Ӧѡ���ռ������ķ�������
��4���Ѹ��﴿����KClO3��MnO2�Ļ����3.45gװ����Թ��У�������ȡO2 �� ����Ӧ��ȫ���Թ���ȴ���õ�2.49g�������ʡ��Լ���������MnO2��������
���𰸡�
��1���ƾ���,����©��
��2��CaCO3+2HCl=CaCl2+H2O+CO2��,���
��3��A,2KMnO4 ![]() K2MnO4+MnO2+O2��,��ˮ��
K2MnO4+MnO2+O2��,��ˮ��
��4��1g
����������1�����Ǿƾ��ƣ����dz���©����
��2������ʯ����Ҫ�ɷ���̼��ƣ���ϡ���ᷴӦ�������Ȼ��ơ�ˮ��������̼��������̼��ʹ��ɫ��ʯ����Һ��죻
��3�����ȹ�����ȡ������ѡ����װ�� A ����Ӧ�Ļ�ѧ����ʽ�ǣ�2KMnO4 ![]() K2MnO4+MnO2+O2����Ҫ�ϼ��ػ����ƿ��ͬŨ�ȵ��������������ſ������ռ����壬�ɵõ���ͬŨ�ȵ�������
K2MnO4+MnO2+O2����Ҫ�ϼ��ػ����ƿ��ͬŨ�ȵ��������������ſ������ռ����壬�ɵõ���ͬŨ�ȵ�������
��4������KClO3��MnO2�Ļ������ɵ������ɵ����ܵ�����������ٵ���������������������������������������Ϊ:3.45g-2.49g=0.96g.����������KClO3������Ϊx��
2KClO3 ![]() 2KCl+3O2��
2KCl+3O2��
245 96
x 0.96g![]() =
=![]()
x=2.45g
���Ի������MnO2������Ϊ��3.45g-2.45g=1g��
�ʴ�Ϊ����1���ƾ��ƣ�����©������2��CaCO3+2HCl=CaCl2+H2O+CO2��;��죻��3��A��2KMnO4![]() K2MnO4+MnO2+O2������ˮ����4��1g��
K2MnO4+MnO2+O2������ˮ����4��1g��
��1�����ݳ������������ƽ�ɣ�
��2��̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��������̼��ˮ��Ӧ����̼�ᣬ̼����ʹ��ɫʯ����ɫ��
��3��ʵ�����ø��������ȡ����ʱ����������ڼ��ȵ���������������ء��������̺����������ݷ�Ӧ���״̬�ͷ�Ӧ������ѡ����װ�ã���ˮ���ռ�������������
��4�����������غ㶨�ɼ�������������������Ȼ�����ݻ�ѧ����ʽ���м��������ص��������̶�������������̵�������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�