题目内容
现将20g Cu-Zn合金放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物的质量为69.8g.
求:①产生氢气的质量;
②求出该合金中铜的质量分数.
解:(1)氢气的质量=(20+50)-69.8=0.2(g)
(2)设Cu-Zn合金中锌的质量为X,根据题意得:
Zn+H2SO4=ZnSO4+H2
65 2
X 0.2g
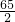 =
= X=6.5g
X=6.5g
那么铜是质量:20-6.5=13.5(g)
合金中铜的质量分数= ×100%=67.5%
×100%=67.5%
答:①产生氢气的质量0.2g;该合金中铜的质量分数67.5%.
分析:根据金属活动性顺序表可知,Cu不与酸反应;所以20g Cu-Zn合金中只有锌与稀硫酸反应生成了硫酸锌和氢气,又知反应前物质的质量(20+50=70克)与反应后物质质量(69.8g)减少的质量即为氢气的质量;然后可以根据化学方程式可求出Cu-Zn合金中锌的质量,那么铜的质量就可以解得,最后根据纯度计算公式= ×100%解答出合金中铜的质量分数.
×100%解答出合金中铜的质量分数.
点评:本题通过金属混合物的质量和稀硫酸的质量,由金属活动性和剩余物质的质量得出气体的质量,解题的关键是要抓住只有锌与稀硫酸反应,然后利用化学方程式进行计算即可.
(2)设Cu-Zn合金中锌的质量为X,根据题意得:
Zn+H2SO4=ZnSO4+H2
65 2
X 0.2g
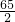 =
= X=6.5g
X=6.5g那么铜是质量:20-6.5=13.5(g)
合金中铜的质量分数=
 ×100%=67.5%
×100%=67.5%答:①产生氢气的质量0.2g;该合金中铜的质量分数67.5%.
分析:根据金属活动性顺序表可知,Cu不与酸反应;所以20g Cu-Zn合金中只有锌与稀硫酸反应生成了硫酸锌和氢气,又知反应前物质的质量(20+50=70克)与反应后物质质量(69.8g)减少的质量即为氢气的质量;然后可以根据化学方程式可求出Cu-Zn合金中锌的质量,那么铜的质量就可以解得,最后根据纯度计算公式=
 ×100%解答出合金中铜的质量分数.
×100%解答出合金中铜的质量分数.点评:本题通过金属混合物的质量和稀硫酸的质量,由金属活动性和剩余物质的质量得出气体的质量,解题的关键是要抓住只有锌与稀硫酸反应,然后利用化学方程式进行计算即可.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
 某学习小组利用右图装置完成如下实验,以验证所学物质的性质.
某学习小组利用右图装置完成如下实验,以验证所学物质的性质.
(1)若A中盛有浓盐酸,B中盛有紫色的石蕊试液,将A、B中液体分别滴入烧杯①、②中,一段时间后观察到的现象是________.
(2)化学反应通常伴随能量的变化,可借助反应前后的温度变化来判断是否发生了反应.在不使用温度计的情况下,若A中盛有稀盐酸,烧杯①中盛有固体氢氧化钠,将A中的稀盐酸滴入烧杯①,观察到气球变瘪,则证明反应发生了.有的同学提出:该现象不足以证明NaOH与稀盐酸发生了化学反应.他的理由是:________.(填一种即可)
(3)若将集气瓶中充满CO2,先将B中盛放的NaOH溶液滴入烧杯②中少量,会看到气球微微变鼓;再将A中的液体滴入烧杯①.请根据下列实验现象将下表中的试剂补充完整.
现象 装置 | ① 气球变瘪又恢复原状 | ② 气球变瘪 | ③ 气球先变瘪后又变得更鼓 |
| 滴管A | ________ | ________ | H2O |
| 烧杯① | H2O | 固体Na2CO3 | ________ |
以下是某同学对发生变化或事物的分析,有错误的是
| A、物质及所属类别 | B、变化及分析 |
| ①氧气、氢气、金刚石单质 ②NaCl、硫酸钾、NaHCO3盐 ③氧化铁、过氧化氢、氧化钠氧化物 | ①电解水分子发生改变 ②物体受热膨胀分子体积变大 ③远处闻到花香分子是不断运动的 |
| C、化学反应及所属类型 | D、事故及处理措施 |
①C+H2O(气) CO+H2---置换反应 CO+H2---置换反应②Na2O+H2O═2NaOH---化合反应 ③KOH+HNO3═KNO3+H2O复分解反应 | ①炒菜油锅着火用锅盖盖灭 ②浓硫酸沾在皮肤上用水冲洗,涂上小苏打溶液 ③图书馆着火---用二氧化碳灭火器灭火 |
- A.A
- B.B
- C.C
- D.D