题目内容
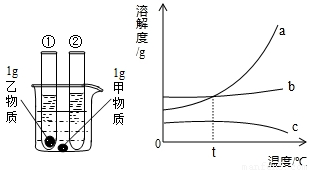
25、如图所示,在室温情况下,烧杯中盛装的是甲物质的溶液,试管①中盛装的是乙物质的溶液,试管②中盛装的是丙物质的溶液.当它们由室温升到80℃时,发现烧杯中甲物质没有明显变化,而试管①中盛装的是乙物质全部溶解,试管②中有丙物质析出.请你据此现象回答下列有关问题:
(1)室温时,
(2)上图能表示甲物质的溶解度曲线的是
(3)若乙物质溶液中混有少量的甲物质,可采取的提纯方法是
(4)若将试管①从烧杯中取出冷却至室温后,从溶液中析出的固体质量为
(5)在温度

(1)室温时,
试管②
(选填“烧杯”、“试管①”或“试管②”)中溶液可能是不饱和溶液;(2)上图能表示甲物质的溶解度曲线的是
b
(选填a、b或c,下同),能表示丙物质的溶解度曲线的是c
;(3)若乙物质溶液中混有少量的甲物质,可采取的提纯方法是
降温结晶
(选填“降温结晶”、“蒸发结晶”);(4)若将试管①从烧杯中取出冷却至室温后,从溶液中析出的固体质量为
1
g;(5)在温度
高于t℃
时,乙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大.分析:(1)根据溶液中是否有未溶解的固体,分析室温时溶液的的状态;
(2)根据温度改变固体物质的变化,分析物质的溶解度与温度的关系,对比溶解度曲线,判断曲线所代表的物质;
(3)根据物质溶解度与温度的关系,判断提纯物质的方法;
(4)根据溶液的状态,分析溶液析出固体的质量;
(5)根据饱和溶液溶质质量分数与溶解度的关系,比较饱和溶液溶质分数的大小.
(2)根据温度改变固体物质的变化,分析物质的溶解度与温度的关系,对比溶解度曲线,判断曲线所代表的物质;
(3)根据物质溶解度与温度的关系,判断提纯物质的方法;
(4)根据溶液的状态,分析溶液析出固体的质量;
(5)根据饱和溶液溶质质量分数与溶解度的关系,比较饱和溶液溶质分数的大小.
解答:解:(1)室温时,烧杯和试管①中都有未溶解的固体物质,说明此时它们都是饱和溶液,而试管②中未有未溶解的固体,因此可判断,室温时试管②中的溶液可能是不饱和溶液;
故答案为:试管②;
(2)当温度从室温升高至80℃时,烧杯中的甲物质未溶解的固体质量基本不变,说明甲物质的溶解度受温度影响较小,这与曲线b一致;
故选B;
(3)温度升高时,未溶解的乙物质固体全部溶解,说明物质乙的溶解度受温度影响较大,而物质甲的溶解度受温度影响不大,所以当乙中混有少量甲时,可采取降温结晶的方法提纯乙;
故答案为:降温结晶;
(4)室温时乙物质的溶液为饱和溶液且有未溶解的固体乙1g,而升温后全部溶解,因此当温度恢复到室温时,所溶解的1g固体会再次析出;
故答案为:1;
(5)乙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大,则满足乙物质的溶解度大于甲物质的溶解度即可;根据溶解度曲线图,当温度高于t℃乙物质的溶解度大于甲物质的溶解度;
故答案为:高于t℃.
故答案为:试管②;
(2)当温度从室温升高至80℃时,烧杯中的甲物质未溶解的固体质量基本不变,说明甲物质的溶解度受温度影响较小,这与曲线b一致;
故选B;
(3)温度升高时,未溶解的乙物质固体全部溶解,说明物质乙的溶解度受温度影响较大,而物质甲的溶解度受温度影响不大,所以当乙中混有少量甲时,可采取降温结晶的方法提纯乙;
故答案为:降温结晶;
(4)室温时乙物质的溶液为饱和溶液且有未溶解的固体乙1g,而升温后全部溶解,因此当温度恢复到室温时,所溶解的1g固体会再次析出;
故答案为:1;
(5)乙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大,则满足乙物质的溶解度大于甲物质的溶解度即可;根据溶解度曲线图,当温度高于t℃乙物质的溶解度大于甲物质的溶解度;
故答案为:高于t℃.
点评:对于某温度下的饱和溶液,溶质质量分数=$\frac{该温度下的溶解度}{100g+溶解度}×100%$,溶解度大则溶质质量分数大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 11、如图所示,在室温情况下,烧杯中盛装的是甲物质的溶液,试管①中盛装的是乙物质的溶液,试管②中盛装的是丙物质的溶液.当它们由室温升到80℃时,发现烧杯中甲物质没有明显变化,而试管①中盛装的是乙物质全部溶解,②试管②中有丙物质析出.请你据此现象回答下列有关问题:
11、如图所示,在室温情况下,烧杯中盛装的是甲物质的溶液,试管①中盛装的是乙物质的溶液,试管②中盛装的是丙物质的溶液.当它们由室温升到80℃时,发现烧杯中甲物质没有明显变化,而试管①中盛装的是乙物质全部溶解,②试管②中有丙物质析出.请你据此现象回答下列有关问题: