题目内容
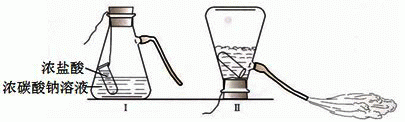
 24、某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后锥形瓶中残留废液进行探究.
24、某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后锥形瓶中残留废液进行探究.【提出问题】
废液中所含溶质是什么物质?
【猜想与假设】
猜想(一):废液中的溶质可能是NaCl、Na2CO3和HCl.猜想(二):废液中的溶质只有NaCl.
猜想(三):废液中的溶质是NaCl和HCl.猜想(四):废液中的溶质是
Na2CO3和NaCl
.【讨论与交流】
小明认为猜想(一)无需验证就知道是错误的.他的理由是
在溶液中Na2CO3和HCl不能共存
.【实验与结论】
(1)为验证猜想(二),小强同学取少量废液装入试管中,然后滴入AgNO3溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解.于是小强认为猜想(二)正确.小强的实验
不能
(填“能”或“不能”)验证猜想(二)的正确性,原因是溶液中若有HCl,遇AgNO3溶液也能产生不溶于稀HNO3的白色沉淀
.(2)小丽为验证猜想(三),选用大理石做试剂.若猜想(三)是正确的,验证时反应的化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(3)若验证猜想(四)是否正确,下列试剂中可选用的有
②③
(填序号).①氢氧化钠溶液 ②氯化钙溶液 ③稀盐酸 ④氯化钾溶液
【拓展与应用】
若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行
蒸发
操作即可从废液中得到NaCl固体.此方法的缺点是挥发出的HCl气体会污染空气
.分析:碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,二者不能共存,氯离子能与硝酸银中的银离子结合产生氯化银白色沉淀,碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,要检验碳酸钠的存在,可以使用加酸化气以及加入可溶性钙钡化合物产生沉淀的方法,要得到氯化钠固体,可以使用蒸发的方法.
解答:解:【猜想与假设】碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,二者不能共存,根据反应物以及生成的物质,可以对废液中的溶质进行猜想,所以本题答案为:Na2CO3和NaCl,在溶液中
Na2CO3和HCl不能共存;
【实验与结论】(1)氯离子能与硝酸银中的银离子结合产生氯化银白色沉淀,而含有氯离子的物质还可能有盐酸,所以本题答案为:不能,溶液中若有HCl,遇AgNO3溶液也能产生不溶于稀HNO3的白色沉淀;
(2)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,所以本题答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)要检验碳酸钠的存在,可以使用加酸化气以及加入可溶性钙钡化合物产生沉淀的方法,所以本题答案为:②③;
【拓展与应用】要将氯化钠和盐酸分离,氯化氢易挥发,因而可以使用蒸发的方法,但是挥发出的氯化氢易造成空气污染,所以本题答案为:蒸发,挥发出的HCl气体会污染空气.
Na2CO3和HCl不能共存;
【实验与结论】(1)氯离子能与硝酸银中的银离子结合产生氯化银白色沉淀,而含有氯离子的物质还可能有盐酸,所以本题答案为:不能,溶液中若有HCl,遇AgNO3溶液也能产生不溶于稀HNO3的白色沉淀;
(2)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,所以本题答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)要检验碳酸钠的存在,可以使用加酸化气以及加入可溶性钙钡化合物产生沉淀的方法,所以本题答案为:②③;
【拓展与应用】要将氯化钠和盐酸分离,氯化氢易挥发,因而可以使用蒸发的方法,但是挥发出的氯化氢易造成空气污染,所以本题答案为:蒸发,挥发出的HCl气体会污染空气.
点评:本题考查了碳酸钠与盐酸的反应以及碳酸钠和氯离子的检验,完成此题,可以依据碳酸钠和盐酸的性质以及常见离子的检验方法进行.

练习册系列答案
相关题目

 (2013?昭通)(1)甲、乙、丙是初中化学中常见的物质,其转化关系如图所示(反应条件已省略).甲、乙、丙三种物质中都含有同一种元素.
(2013?昭通)(1)甲、乙、丙是初中化学中常见的物质,其转化关系如图所示(反应条件已省略).甲、乙、丙三种物质中都含有同一种元素.