题目内容
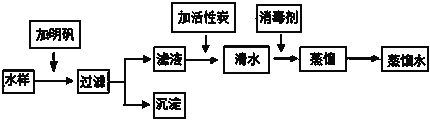
【题目】某市一家大型化工厂回收含铜废料的生产流程如下:
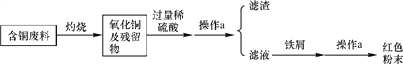
(1)写出流程图中一种氧化物的化学式________;
(2)写出加入稀硫酸反应的化学方程式________________________________;
(3)操作a的名称是________,需要的玻璃仪器有烧杯、玻璃棒、________;
(4)加入铁屑后反应的现象是______________________________________,其目的是________________________________________________。
【答案】 CuO CuO+H2SO4===CuSO4+H2O 过滤 漏斗 有气泡产生,有红色物质析出,溶液由蓝色变成浅绿色 除去多余的稀硫酸、置换硫酸铜溶液中的铜元素
【解析】分析:(1)从铜在空气中灼烧生成氧化铜进行分析;
(2)从金属氧化物与酸反应生成盐和水进行分析;
(3)从不溶性物质和可溶性物质的分离以及过滤操作进行分析;
(4)从金属活动性以及实验目的进行分析。
解答:含铜的废料在灼烧的情况下,铜会与空气中氧气发生反应,生成氧化铜;氧化铜与过量的稀硫酸反应生成硫酸铜和水;加入铁屑以后可以出去多余的稀硫酸,同时铁与硫酸铜反应,把硫酸铜里的铜置换出来,从而回收铜。
故本题答案为:(1). ![]() (2).
(2). ![]() (3). 过滤、漏斗 (4). 有气泡产生,有红色物质析出,溶液由蓝色变成浅绿色;除去多余的稀硫酸、置换硫酸铜溶液中的铜元素。
(3). 过滤、漏斗 (4). 有气泡产生,有红色物质析出,溶液由蓝色变成浅绿色;除去多余的稀硫酸、置换硫酸铜溶液中的铜元素。

 名校课堂系列答案
名校课堂系列答案【题目】化学物质之间的反应奥妙无穷。在一次化学探究活动中,同学们从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白。
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应。
第一组同学设计了实验方案一:
实验步骤 | 实验现象 | 结论 |
先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH | pH逐渐________(填“变大”或“变小”),最后pH≥7 | 稀盐酸与氢氧化钠溶液发生了反应 |
①请你分析:上述方案中为什么强调只有测得的pH≥7才能证明反应了?_____________________________________________。
②写出稀盐酸与氢氧化钠溶液反应的化学方程式________________________________。
(2)第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
实验步骤 | 实验现象 | 结论 |
取少量上述反应后的溶液于试管中,滴加酚酞溶液 | 若______________ | 氢氧化钠溶液过量 |
若无明显现象 | 稀盐酸与氢氧化钠溶液恰好完全反应 |
此时有同学提出方案二不能证明稀盐酸与氢氧化钠溶液恰好完全反应,其原因是________________________________,为此,还需要选择________________或________,再进行实验即可。
【题目】在一个密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,可判断该容器中发生化学反应的基本类型为( )
物质 | A | B | C | D |
反应前质量/g | 2 | 2 | 32 | 5 |
反应后质量/g | 待定 | 20 | 0 | 12 |
A.C=A+B+D B.B+C+D=A C.A=B+C+D D.B+D=A+C