��Ŀ����
����Ŀ����������װ�ý����������ȡ���ռ����ش��������⣺
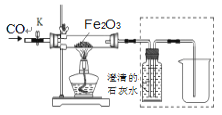
��1����д���������ƣ�a._________��
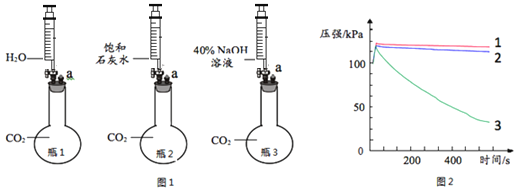
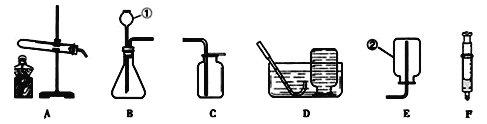
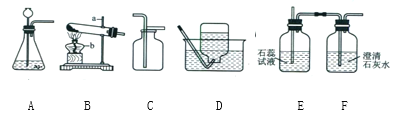
��2��ʵ�����ﲻʹ�ô�����ȡ����ʱ����ѡ�õķ���װ����______������ĸ����ʵ������ȡCO2����ʱ������Ӧ�Ļ�ѧ����ʽΪ___________���ռ�CO2һ�㲻ѡ��װ��D��ԭ����__________��ͬѧ��ͼ��װ��A��E��F����Ʊ�CO2���岢��֤������ʣ���װ��AӦ��������װ��______��ѡ�E����F ������Eװ���е�������_________��װ��E��F�зֱ�����Ӧ�ķ���ʽ___________��_________��
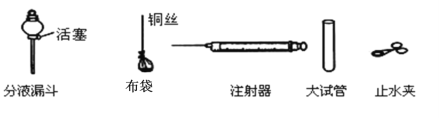
��3����װ��A�з�Ӧ���ھ��ң��Ӱ�ȫ�Ƕȿ��ǿɲ�ȡ�Ĵ�ʩ��________������ţ���
a�����ݻ���С����ƿ
b��������©��������Ͳ����Һ��ĵμ��ٶ�
c�����ȷ�Ӧ��
d������Һ�巴Ӧ���Ũ��
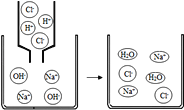
��4��ij��ѧ��ȤС������ʦָ������ȡ������ռ���������̽��������һЩ���ʡ�
���������ϣ�
a������ͨ����������д̼�����ζ����ɫ���壬�ܶȱȿ���С����������ˮ��
b����ˮ�ǰ�����NH3����ˮ��Һ�����м�����ʡ�
c������Һ��ʹ��ɫ��̪��Һ��졣
��ͼΪ�ϳɰ���ģ��ʵ��װ��ͼ���������������ۺ�ʯ������ɵĻ�����
���裺�ټ�������ԣ���ʹп����ϡ���ᷴӦһ��ʱ�䣻����Y��ʢ���������ƺ��Ȼ�隣�����Һ��һ���ȣ�NH4Cl + NaNO2 ![]() NaCl + 2H2O + N2�� �����ܵ����������Ͽ�ʱ���ٵ�ȼ�������·��ľƾ��ƽ��м��ȡ�
NaCl + 2H2O + N2�� �����ܵ����������Ͽ�ʱ���ٵ�ȼ�������·��ľƾ��ƽ��м��ȡ�
�ٷ�Ӧ��ʼǰʹп����ϡ���ᷴӦһ��ʱ���Ŀ���ǣ�__________��
�ڵ���ƿ�г���__________ ����,��ʾ�а������ɡ�
��д�������������ɰ����Ļ�ѧ����ʽ_______________��

���𰸡�����̨ B CaCO3+2HCl=CaCl2+H2O+CO2�� ������̼������ˮ������ˮ��Ӧ E ��ɫʯ����Һ��� CO2 + H2O = H2CO3 CO2 +Ca(OH)2 =CaCO3��+ H2O bd �ž�װ���еĿ��� ��ɫ��̪��Һ��� N2+3H2 ![]() 2NH3
2NH3
��������
��1������a����������̨��
��2��ʵ�������ü��ȸ��������ȡ������������������Ӧ���ڹ�������ͣ��ʿ�ѡ�÷���װ��B��ʵ������ȡ������̼�ô���ʯ��ϡ���ᣬ��Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼����Ӧ����ʽ��CaCO3+2HCl=CaCl2+H2O+CO2����������̼������ˮ������ˮ��Ӧ����һ�㲻����ˮ���ռ������������̼������ʱ������Ҫ�ӳ��ܽ��룬����Һ��ֽӴ���������ͨ��F�����������ų��������۲���ͨ��E�����������̼��ˮ��Ӧ����̼�ᣬ̼���ʹʯ���죬��ʹ����ʯ��ˮ����ǣ�ͬѧ��ͼ��װ��A��E��F����Ʊ�CO2���岢��֤������ʣ���װ��AӦ��������װ��E��Eװ���е���������ɫʯ����Һ��죻װ��E��F�зֱ����Ƕ�����̼��ˮ��Ӧ����̼�ᣬ������̼���������Ʒ�Ӧ����̼��ƺ�ˮ����Ӧ�ķ���ʽ�ֱ�Ϊ��CO2 + H2O = H2CO3��CO2 +Ca(OH)2 =CaCO3��+ H2O��
��3��Ҫ������Ӧ���ʣ��ɿ��Ʒ�Ӧ��Ӵ���Ӧ����Һ��Ũ�ȣ���Ӧ����¶ȵȣ�
a�����ݻ���С����ƿ����Ӧ���ɵĽ϶��������ų�������ȫ�����ܼ�����Ӧ���ʣ���a����
b��������©��������Ͳ����Һ��ĵμ��ٶȣ��Ӷ��ɿ��Ʒ�Ӧ���ʣ���b��ȷ��
c�����ȷ�Ӧ���Ӧ���ʼӿ죬�����������࣬����ȫ�����ܼ�����Ӧ���ʣ���c����
d������Һ�巴Ӧ���Ũ�ȣ��ɼ�����Ӧ���ʣ���d��ȷ����ѡbd��
��4���������п�ȼ�ԣ���ȼ�����ʱ������ը����Ӧ��ʼǰʹп����ϡ���ᷴӦһ��ʱ���Ŀ���ǣ��ų�װ���ڲ��Ŀ�������ֹ���ܷ����ı�ը��
��5�����ݡ���ˮ�ǰ�����NH3����ˮ��Һ�����м�����ʡ���������Һ��ʹ��ɫ��̪��Һ��족��֪������ƿ�г��ַ�̪��Һ�������ʾ�а������ɣ�
��6�����������ṩ����Ϣ��֪��п����������������������ƺ��Ȼ�隣�����Һ���������˵����������뵪�����д����ͼ������������ɰ����������������ɰ����Ļ�ѧ����ʽΪ��N2+3H2 ![]() 2NH3��
2NH3��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�����Ŀ����ʯͷֽ��������ĥ�ɷ�ĩ��ʯͷΪ��Ҫԭ�����ɵġ�����ֽ��ˮ��̲���ȼ�գ�����Ҫ���Dz��ÿ�����ֽ���dz��������ճ̱�����ǩֽ�ȶ���������̼���Ϊ��Ҫԭ�ϵĵ�̼��ʯͷֽ����Ϊ�ⶨ����̼��Ƶĺ���������С���ͬѧ��ȡ50g��ֽ��Ʒ���ֱ���5ֻ�ձ��н�����ʵ�飬ʵ�����ݼ��±�������ֽ�������ɷּȲ�����ˮ��Ҳ����ˮ�����ᷴӦ����
�ձ��� | �ձ��� | �ձ��� | �ձ��� | �ձ��� | |
������Ʒ������/g | 10 | 10 | 10 | 10 | 10 |
����ϡ���������/g | 10 | 20 | 30 | 40 | 50 |
��ַ�Ӧ���������������/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
��1������X��ֵΪ________��
��2�����ձ�_______��̼�����ȫ��Ӧ��
��3������Ʒ��̼��Ƶ���������_____��