题目内容
a、b两物质的溶解度曲线如图1所示,请根据图回答:(1)20℃时a、b的溶解度 (填“相等”或“不相等”).
(2)30℃时a物质饱和溶液中溶质质量分数为 .该温度下b物质饱和溶液的溶质质量分数一定 (填“大于”或“小于”)a物质饱和溶液中溶质质量分数.
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a、b剩余,向烧杯的水中加入氢氧化钠固体,加入氢氧化钠后引起的下列变化叙述正确的是 (不考虑溶剂的蒸发,析出的固体不含水).
A.a溶液中溶质质量增多,b溶液中溶质质量减少
B.a溶液中溶质质量分数大于b溶液中溶质质量分数
C.a溶液中溶剂质量小于b溶液中溶剂质量
D.试管底部a固体的质量小于b固体的质量.

【答案】分析:(1)溶解度曲线的交点表示该温度下几种物质的溶解度相等,可以据此解答;
(2)根据溶解度和溶质的质量分数的关系来完成解答;
(3)根据氢氧化钠溶于水后要放出热量使溶液的温度升高,结合ab两物质受温度变化的影响来进行分析判断并作出解答.
解答:解:(1)从溶解度曲线上可以看出,在20℃时a和b的溶解度曲线相交,所以在20℃时a、b的溶解度相等;
(2)溶解度的定义为:在一定温度下,在100g水中达到饱和时所溶解的固体的质量,30℃时a物质的溶解度为40g,所以在30℃时a物质饱和溶液中溶质质量分数为: ×100%=28.6%;该温度下b的溶解度小于a的溶解度,所以b物质饱和溶液的溶质质量分数一定小于a物质的饱和溶液的溶质质量分数;
×100%=28.6%;该温度下b的溶解度小于a的溶解度,所以b物质饱和溶液的溶质质量分数一定小于a物质的饱和溶液的溶质质量分数;
(3)氢氧化钠溶于水要使溶液的温度升高,所以:
A、a的溶解度随温度升高而增大,由于溶液温度升高,所以a物质要溶解,即a溶液中溶质的质量增大;b物质的溶解度随温度的升高而降低,所以b溶液要析出一部分溶质,故A正确;
B、根据A的分析可以知道a溶液由于溶质的质量增加而使溶质的质量分数增大,而b溶液由于溶质的析出而使溶质的质量分数减小,故a溶液中溶质质量分数大于b溶液中溶质质量分数,故B正确;
C、由于20℃时,a和b的溶解度相等,所以等质量的a、b饱和溶液的中所含的溶质的质量相等,那么溶剂的质量也相等,而加入氢氧化钠后只是溶液的温度改变导致溶质的质量改变,对溶剂的质量没有影响,故a溶液和b溶液中溶剂的质量没有改变,故C不正确;
D、根据A的分析可以知道,a溶液中又溶解了部分固体,而b溶液中析出了部分固体,所以试管底部a固体的质量小于b固体的质量,故D正确;
故选ABD.
故答案为:(1)相等;
(2)28.6%;小于;
(3)ABD.
点评:本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力,同时要注意本题(3)中隐含的条件,氢氧化钠溶于水后会使溶液的温度升高.
(2)根据溶解度和溶质的质量分数的关系来完成解答;
(3)根据氢氧化钠溶于水后要放出热量使溶液的温度升高,结合ab两物质受温度变化的影响来进行分析判断并作出解答.
解答:解:(1)从溶解度曲线上可以看出,在20℃时a和b的溶解度曲线相交,所以在20℃时a、b的溶解度相等;
(2)溶解度的定义为:在一定温度下,在100g水中达到饱和时所溶解的固体的质量,30℃时a物质的溶解度为40g,所以在30℃时a物质饱和溶液中溶质质量分数为:
 ×100%=28.6%;该温度下b的溶解度小于a的溶解度,所以b物质饱和溶液的溶质质量分数一定小于a物质的饱和溶液的溶质质量分数;
×100%=28.6%;该温度下b的溶解度小于a的溶解度,所以b物质饱和溶液的溶质质量分数一定小于a物质的饱和溶液的溶质质量分数;(3)氢氧化钠溶于水要使溶液的温度升高,所以:
A、a的溶解度随温度升高而增大,由于溶液温度升高,所以a物质要溶解,即a溶液中溶质的质量增大;b物质的溶解度随温度的升高而降低,所以b溶液要析出一部分溶质,故A正确;
B、根据A的分析可以知道a溶液由于溶质的质量增加而使溶质的质量分数增大,而b溶液由于溶质的析出而使溶质的质量分数减小,故a溶液中溶质质量分数大于b溶液中溶质质量分数,故B正确;
C、由于20℃时,a和b的溶解度相等,所以等质量的a、b饱和溶液的中所含的溶质的质量相等,那么溶剂的质量也相等,而加入氢氧化钠后只是溶液的温度改变导致溶质的质量改变,对溶剂的质量没有影响,故a溶液和b溶液中溶剂的质量没有改变,故C不正确;
D、根据A的分析可以知道,a溶液中又溶解了部分固体,而b溶液中析出了部分固体,所以试管底部a固体的质量小于b固体的质量,故D正确;
故选ABD.
故答案为:(1)相等;
(2)28.6%;小于;
(3)ABD.
点评:本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力,同时要注意本题(3)中隐含的条件,氢氧化钠溶于水后会使溶液的温度升高.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
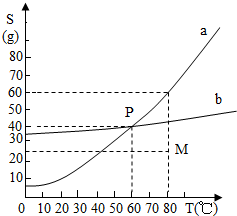 如如图所示为a、b两物质的溶解度曲线,下列根据如图所示中M点和P点,得到的正确信息是( )
如如图所示为a、b两物质的溶解度曲线,下列根据如图所示中M点和P点,得到的正确信息是( )| A、60℃时,a、b两物质饱和溶液的质量分数都为40% | B、80℃时,100g水中溶解25g的a的物质,溶液不饱和 | C、80℃时,将a、b两物质的饱和溶液降温到20℃时,只有a物质析出 | D、向M点的任意量a溶液中,加入(60-25)g溶质,溶液一定达到饱和 |
 25、如图为a、b、c三种物质的溶解度曲线.
25、如图为a、b、c三种物质的溶解度曲线.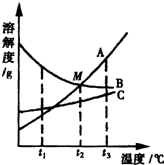 25、A、B、C三种物质的溶解度曲线如右图所示,请回答:
25、A、B、C三种物质的溶解度曲线如右图所示,请回答: (2012?集美区质检)如图是A、B两种固体物质的溶解度随温度变化的曲线.请回答:
(2012?集美区质检)如图是A、B两种固体物质的溶解度随温度变化的曲线.请回答: