题目内容
【题目】同学们利用“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
【实验探究】
(1)A、B、C、D四组同学分别进行了下列实验
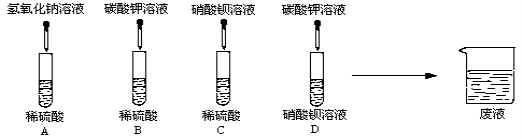
写出下列的两个化学方程式:
①A中的反应 。
②D中的反应 。
【挖掘实质】
下图是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O
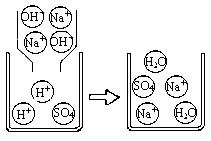
【实践运用】
完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,用无色溶液滴加紫色石蕊试剂,变为红色。
(1)①溶液中的白色沉淀一定是 ,理由是 。
(2)废液中一定不含有的离子是 。
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有 | ②取滤液滴加 | 现象明显 | 含有该离子 |
【答案】(1)①H2SO4+2NaOH==Na2SO4+2H2O
②K2CO3+Ba(NO3)2==BaCO3↓+2KNO3
【实践运用】(1)硫酸钡。BaSO4与酸不反应,而BaCO3要与酸反应
(2)OH- CO32-
(3)可能含硫酸根离子
溶液中可能有的离子 | 实验步骤 |
①可能含硫酸根离子 | ②向滤液中加入硝酸钡(或氯化钡、氢氧化钡等) |
(二)可能含钡离子
溶液中可能有的离子 | 实验步骤 |
①可能含钡离子 | ②向溶液中加入稀硫酸(或硫酸钠等)溶液 |
【解析】
试题分析:(1)①根据图示可知:试管A中的稀硫酸能与加入的氢氧化钠中和反应生成盐和水,化学方程式为:H2SO4+2NaOH==Na2SO4+2H2O
②D为碳酸钾加入硝酸钡中,二者可发生复分解反应生成碳酸钡沉淀和硝酸钾,反应的化学方程式为:K2CO3+Ba(NO3)2==BaCO3↓+2KNO3
【实践运用】
(1)因题目中的反应发生在硫酸、氢氧化钠、硝酸钡和碳酸钾之间;其中氢氧根离子能和氢离子结合形成水分子(A中);碳酸根离子可与氢离子结合形成水分子和二氧化碳分子(B中);碳酸根离子也可与钡离子结合形成碳酸钡沉淀(D中)。当“废液中出现白色沉淀”时,该沉淀一定为钡的沉淀。其中硫酸钡和碳酸钡均为沉淀。由于 “加入紫色石蕊试液时,变为红色”,说明溶液呈酸性,即含较多的氢离子。因为碳酸钡可与酸反应,而硫酸钡不与酸反应。所以沉淀只有硫酸钡。
(2)向溶液中“加入紫色石蕊试液时,变为红色”,说明溶液呈酸性,即含较多的氢离子。由于氢离子能和氢氧根离子结合形成水分子;可与碳酸根离子结合形成水分子和二氧化碳分子;所以氢氧根离子和碳酸根离子一定不存在。
(3)根据题意可知:钠离子和硝酸根离子未形成沉淀或气体,所以一定存在于所得的溶液中。结合上面的分析可知:所得溶液中一定含氢离子、钠离子和硝酸根离子,一定不含氢氧根离子和碳酸根离子。而在“实践运用”中所得的沉淀是由硫酸根离子和钡离子形成的。所以无法确定所得到的溶液中是否含硫酸根离子或钡离子。即溶液中可能含的离子为硫酸根离子或钡离子(二者只含其一)。因此,实验应为:
(一)可能含硫酸根离子
溶液中可能有的离子 | 实验步骤 |
①可能含硫酸根离子 | ②向滤液中加入硝酸钡(或氯化钡、氢氧化钡等) |
(二)可能含钡离子
溶液中可能有的离子 | 实验步骤 |
①可能含钡离子 | ②向溶液中加入稀硫酸(或硫酸钠等)溶液 |