题目内容
(共12分)为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究。
【对固体猜想】
猜想I:全部是金属铜; 猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭; 猜想Ⅳ:除铜外,还含有氧化铜、 。
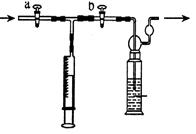
【进行实验】实验流程见下图:

【问题与讨论】
(1)步骤②包括溶解、 两步操作,它们共同用到的玻璃仪器是烧杯、 。
(2)C的化学式为 ,D的化学式为 ,由此推出固体B中含有
(写化学式),步骤④发生反应的化学方程式为 。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为 ,说明样品中含有 ,则证明猜想 成立;如果溶液A无色,则证明猜想 成立。
猜想Ⅳ:木炭 (1)过滤 玻璃棒 (2)CO2 CuO C和Cu
CuO+H2SO4=CuSO4+H2O (3) CuSO4 氧化铜(或CuO)Ⅳ Ⅲ
【解析】【对固体猜想】通过前三个猜想可知其中一定含有铜,关键是看是否含有木炭、氧化铜,所以也有可能木炭和氧化铜都存在;
【问题和讨论】(1)固体粉末最后变成固体与液体分离,所以要先将粉末溶解,进行过滤将不溶于液体的固体与液体分离开;溶解时用到的仪器是烧杯、玻璃棒;过滤时用到铁架台、烧杯、漏斗、玻璃棒;所以共同的玻璃仪器是烧杯和玻璃棒;
(2)气体通入澄清石灰水中变浑浊,说明该气体是二氧化碳;由于黑色固体与硫酸反应生成蓝色溶液,说明黑色固体中含有铜元素,又因为铜与硫酸不反应,所以黑色固体是氧化铜;由于固体B经过灼烧生成二氧化碳和氧化铜,所以固体B中含有木炭和铜;氧化铜与硫酸反应的反应物是氧化铜和硫酸,生成物时硫酸铜和水,用观察法配平;
(3)由于粉末与硫酸反应生成蓝色溶液A,所以A中溶质是硫酸铜,由于铜与硫酸不反应,所以说明粉末中一定含有氧化铜,由于通过后面的推断已经知道其中一定含有木炭了,所以再含有氧化铜时,猜想4就正确了;如果A溶液是无色,说明不存在氧化铜,但还存在木炭,所以猜想3正确