题目内容
(1)金属镓广泛用于制造半导体材料.镓的硫酸盐的化学式为Ga2(SO4)3,其中镓元素的化合价是 价;
(2)肼(N2H4)具有很好的还原性,与氧反应的产物无污染,故可用于除去水中溶解的氧,以保护锅炉等设备.写出肼除氧时发生反应的化学方程式: ,该反应的基本反应类型是 .
(1)+3;(2)N2H4+O2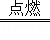 N2+2H2O;置换反应.
N2+2H2O;置换反应.
解析试题分析:(1)硫酸根显﹣2价,设镓元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:2x+(﹣2)×3=0,则x=+3价.
(2)根据题意,肼(N2H4)具有很好的还原性,与氧反应的产物无污染(由质量守恒定律,反应前后元素种类不变,反应物中含有氮、氢、氧三种元素,生成物为氮气和水),
反应的化学方程式为:N2H4+O2 N2+2H2O;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
N2+2H2O;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
考点:有关元素化合价的计算;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
点评:本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、化学方程式的书写方法、置换反应的特征等即可正确解答本题.

练习册系列答案
相关题目
下表是元素周期表的一部分,请根据表中信息回答下列问题:
| 族 周期 | ⅠA | | | | | | | 0 |
| 1 | 1 H 氢 1.008 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2 He 氦 4.003 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)氯元素的相对原子质量是 ,它属于 (填“金属”或“非金属”)元素,在化学反应中容易 (填“得到”或“失去”)电子.
(2)由原子序数为8和13的元素形成的化合物的化学式是 .
(3)第二、三周期的元素排列从左往右所遵循的规律是 (写一种).