题目内容
高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2Si+4HCl.请计算要获得56g硅(Si),至少需要氢气多少克?
解:设至少需要氢气的质量为x.
SiCl4+2H2=Si+4HCl
4 28
x 56g
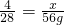 x=8g
x=8g
答:至少需要8g氢气.
分析:根据获得硅的质量,由反应的化学方程式计算出需要氢气的质量即可.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.
SiCl4+2H2=Si+4HCl
4 28
x 56g
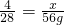 x=8g
x=8g答:至少需要8g氢气.
分析:根据获得硅的质量,由反应的化学方程式计算出需要氢气的质量即可.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
 iCl4 +2H2高温 Si+ 4HCl。请计算要获得56g硅(Si),至少需要氢气的质量。
iCl4 +2H2高温 Si+ 4HCl。请计算要获得56g硅(Si),至少需要氢气的质量。