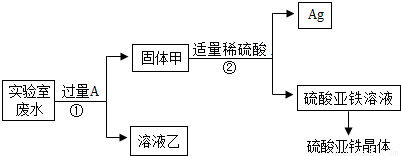
题目内容
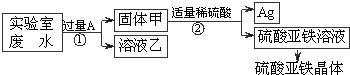
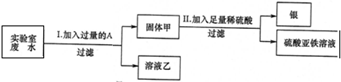
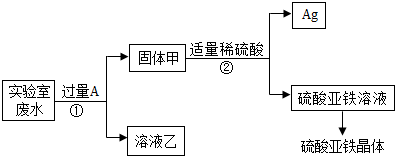
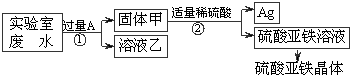
某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:

(1)固体甲中含有的物质是(填化学式)________;溶液乙中有颜色的离子符号为________.
(2)写出步骤①的化学方程式:________,反应②的基本类型是________
(3)检验步骤①向废水中加入A是否过量的物理方法是________.
(4)加入过量A 的目的是________.
解:(1)由题意可知,若想从该废水中回收银,并得到副产品硫酸亚铁晶体,应利用金属活动性顺序,用活泼金属将Ag从AgNO3溶液中置换出来,且实验过程中未引入其它的金属元素,可知,加入的A物质应为Fe,铁能将银从溶液中置换出来不能将锌置换出来,所以,固体甲中含有的物质是Fe和Ag,溶液乙中有颜色的离子符号为亚铁离子,符号为:Fe2+;
(2)在步骤①中铁与硝酸银反应生成了硝酸亚铁和银,反应的化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag;该反应由一种单质和化合物反应,生成了领一种单质和化合物,属于置换反应;
(3)由于铁能被磁铁吸引.所以,检验加入A是否过量的物理方法是:对固体甲磁铁吸铁实验;
(4)加入过量A 的目的是将溶液中银全部置换出来,完全回收银.
故答为:(1)铁,Fe2+;(2)Fe+2AgNO3=Fe(NO3)2+2Ag,置换反应;(3)对固体甲磁铁吸铁实验;(4)完全回收银.
分析:(1)根据题意,若想从该废水中回收银,并得到副产品硫酸亚铁晶体,应利用金属活动性顺序,用活泼金属将Ag从AgNO3溶液中置换出来,且实验过程中未引入其它的金属元素,可知,加入的A物质应为Fe,据此分析有关的问题;
(2)根据上述分析,写出步骤①的化学方程式并根据反应的特点分析反应的类型;
(3)根据铁能被磁铁吸引分析;
(4)根据实验的目的分析加入过量A 的目的.
点评:本题考查了金属活动性顺序与置换反应和过滤的原理等知识,要记住锌、铁、银的活动性,并学会从实验方案图中提炼有用的信息.
(2)在步骤①中铁与硝酸银反应生成了硝酸亚铁和银,反应的化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag;该反应由一种单质和化合物反应,生成了领一种单质和化合物,属于置换反应;
(3)由于铁能被磁铁吸引.所以,检验加入A是否过量的物理方法是:对固体甲磁铁吸铁实验;
(4)加入过量A 的目的是将溶液中银全部置换出来,完全回收银.
故答为:(1)铁,Fe2+;(2)Fe+2AgNO3=Fe(NO3)2+2Ag,置换反应;(3)对固体甲磁铁吸铁实验;(4)完全回收银.
分析:(1)根据题意,若想从该废水中回收银,并得到副产品硫酸亚铁晶体,应利用金属活动性顺序,用活泼金属将Ag从AgNO3溶液中置换出来,且实验过程中未引入其它的金属元素,可知,加入的A物质应为Fe,据此分析有关的问题;
(2)根据上述分析,写出步骤①的化学方程式并根据反应的特点分析反应的类型;
(3)根据铁能被磁铁吸引分析;
(4)根据实验的目的分析加入过量A 的目的.
点评:本题考查了金属活动性顺序与置换反应和过滤的原理等知识,要记住锌、铁、银的活动性,并学会从实验方案图中提炼有用的信息.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目