题目内容
【题目】(11分)现实验室有一瓶久置的NaOH溶液,为检验其是否变质,溶液中的溶质是什么,九(5)班同学设计实验并进行验证。
【提出问题】待测液中的溶质是什么?
(1)请你用化学方程式写出NaOH溶液变质的原因:
【提出猜想】
(2)猜想一:NaOH,猜想二:Na2CO3,猜想三:
【设计方案】
(3)实验方案(一):取少量待测溶液于试管中,向其中滴加无色酚酞溶液,若溶液变红,则说明该待测溶液没有变质,猜想一正确。
请你判断该方案是否合理 ,理由是
实验方案(二):取少量待测溶液于试管中,向其中滴加几滴稀盐酸,若溶液中没有出现气泡,则说明该待测溶液没有变质了,猜想一正确。小陈同学认为该结论不合理,请你想一想他的理由 。
实验方案(三):取少量待测溶液于试管中,先向其中加入足量的澄清石灰水,再加入无色酚酞,若观察到先有白色沉淀产生,后溶液变红的现象,则说明猜想三正确。请你写出发生的方程式 。小刘同学提出异议,原因是 。
实验方案(四):取少量待测溶液于试管中,先向其中加入足量的BaCl2溶液,再加入无色酚酞,
若观察到 现象,则说明猜想三正确。
【实验结论】该溶液为部分变质的NaOH溶液。
【反思交流】CO2与NaOH溶液反应没有明显现象,除了选用试剂验证产物碳酸钠的存在能证明两者可以反应外,是否有其他办法证明两者反应呢?
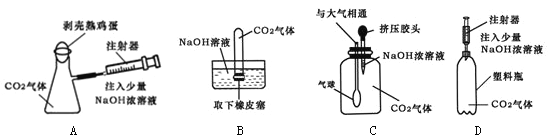
(4)下列四种实验设计,实验中其现象不足以说明CO2与NaOH溶液发生了反应的是
【答案】(1)2NaOH + CO2 === Na2CO3 + H2O (2)Na2CO3和NaOH
(3)实验方案(一)不合理 因为Na2CO3和NaOH溶液都可使酚酞变红
实验方案(二):盐酸只加了几滴,若溶液中有NaOH和Na2CO3,NaOH会先于酸反应。要证明一定没有Na2CO3,盐酸应加足量。
实验方案(三):Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 该反应本身生成NaOH,且Ca(OH)2过量
实验方案(四):先有白色沉淀产生,后溶液变红
(4)B
【解析】
试题分析:(1)NaOH溶液变质的原因是吸收了空气中的二氧化碳,化学方程式为:2NaOH+CO2 ==Na2CO3 + H2O
(2)NaOH溶液变质可能全部变质,也可能部分变质,故猜想3是:Na2CO3和NaOH
(3)实验方案(一)取少量待测溶液于试管中,向其中滴加无色酚酞溶液,若溶液变红,则说明该待测溶液没有变质,该方案不合理;理由是:因为Na2CO3和NaOH溶液都可使酚酞变红;
实验方案(二):盐酸只加了几滴,若溶液中有NaOH和Na2CO3,NaOH会先于酸反应。要证明一定没有Na2CO3,盐酸应加足量
实验方案(三):加入足量的澄清石灰水,观察到有白色沉淀产生的化学方程式:Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH;但是根据有白色沉淀产生,只能说明溶液中含有Na2CO3,根据溶液变红的现象 并不能说明原溶液中含有NaOH,因为该反应本身生成NaOH,且Ca(OH)2过量
实验方案(四):取少量待测溶液于试管中,先向其中加入足量的BaCl2溶液,再加入无色酚酞,若观察到先有白色沉淀产生,发生反应:BaCl2+Na2CO3==BaCO3↓+2NaCl,后溶液变红,说明溶液中含有碱溶液,故可判断溶液中既含有Na2CO3,又含有NaOH,猜想三正确
(4)因为B使用的是大量NaOH溶液,含有水量较多,这样CO2有可能不是和NaOH反应,而是溶解在了水中,同样会形成压强差,出现试管内水面上升的现象,而A、C、D用的都是少量浓NaOH溶液,含水量很少,故选B