题目内容
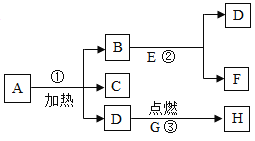
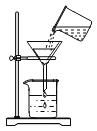
【题目】如图是实验室常用的一些装置。
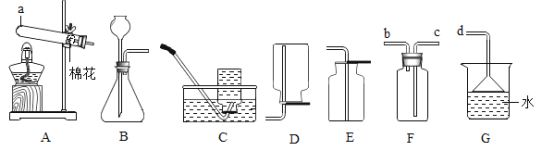
(1)仪器a的名称是___________。
(2)实验室制取并收集二氧化碳气体应选择图中的装置是___________(填字母),检验二氧化碳是否收集满的方法是______________________,则二氧化碳已收集满。
(3)图中用装置A与C连接制取并收集氧气,则装置A中反应的化学方程式为___________,当观察到装置C中___________才开始收集。
(4)SO2通常是一种无色有刺激性气味的气体,密度比空气大,易溶于水。实验室用F、G装置收集一瓶SO2,则F、G装置的导管按气流方向连接的顺序是___________→___________→___________(填字母),水的作用是∶___________________。
【答案】试管 BE 用燃着的木条伸到集器瓶口进行检验,熄灭即满 ![]() 连续、均匀气泡冒出时 c b d 吸收二氧化硫,防止排放到空中污染空气
连续、均匀气泡冒出时 c b d 吸收二氧化硫,防止排放到空中污染空气
【解析】
(1)a是试管;
(2)实验室用稀盐酸与碳酸钙的反应制取二氧化碳,是固液制气不需加热,制气装置应选择B,由于二氧化碳密度比空气大且能溶于水,所以收集装置要用向上排空气法。由于二氧化碳不支持燃烧,所以用燃着的木条来验满放在瓶口,熄灭说明已满,否则不满。
(3)A装置是用加热固体的方法制取氧气,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,化学方程式是![]() ,利用排水法收集气体时,要等导管口气泡连续、均匀冒出时再开始收集,防止收集的气体不纯;
,利用排水法收集气体时,要等导管口气泡连续、均匀冒出时再开始收集,防止收集的气体不纯;
(4)二氧化硫用F收集,最后多余的用水吸收,防止污染。二氧化硫的密度比空气大,因此应该从c进b出,二氧化硫易溶于水,排放到空气中会形成酸雨,因此用水吸收。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】焦炭(主要成分是碳单质,杂质不与水反应) 与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料,可能还有H2、CO、CO2.某小组同学设计了如下实验装置并进行实验。实验后发现 A 装置中溶液变浑浊,D 中的固体由黑色变红色,E 中的固体由 白色变蓝色,G 装置中有水流入烧杯。(已知无水硫酸铜遇水蒸气变蓝,碱石灰能吸收二氧化碳和水蒸气,浓硫酸能吸收水蒸气)。
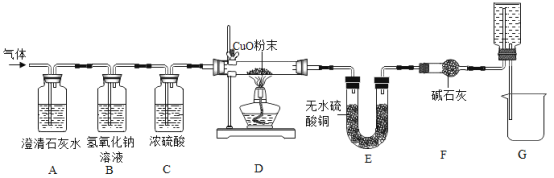
在反应前后对D、E装置进行了质量的测量(各步反应均完全),测量结果如表:
装置及药品 | 反应前 | 反应后 |
D装置中玻璃管与固体的总质量/g | 223.3 | 215.0 |
E装置中U型管与固体的总质量/g | 260.0 | 267.2 |
请分析回答下列问题:
(1)水煤气中一定含有CO2的理由是_____(用化学方程式表示)。
(2)一定能证明水煤气中有氢气存在的实验现象是_____,_____。
(3)G 装置的作用:①“抽气”;②_____。
(4)该小组同学通过数据分析,证明水煤气中存在 CO 气体,请利用上表中的原始数据,列出数据分析过程(只列式不计算)。_____
(5)同学们发现,不通过测量反应前后装置的质量,也可方便的证明 CO 气体的存在。 需增加一个图中的装置_____(填装置序号)来代替装置 F。