题目内容
 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(2)20℃时,向100g水中加入31.6g硝酸钾,充分溶解后得到________(填“饱和”或“不饱和”)溶液.
(3)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是________(填字母,下同).
A.升高温度 B.降低温度 C.再加硝酸钾固体 D.再加水
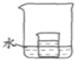
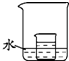
(4)如图所示,小烧杯中盛放的是饱和硝酸钾溶液.若将适量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中有固体析出的是________.
A.冰 B.氧化钙 C.硝酸铵 D.氢氧化钠
(5)下列关于60℃时硝酸钾饱和溶液的说法,正确的是________
A.溶质质量最多为110g
B.溶质质量一定比溶剂多
C.一定比40℃硝酸钾溶液溶质的质量分数大.
解:(1)在不说明溶液溶剂时水一般是该溶液的溶剂;
(2)由于20℃时硝酸钾的溶解度是31.6g,所以20℃时,向100g水中加入31.6g硝酸钾,充分溶解后恰好得该温度下硝酸钾的饱和溶液;
(3)A、因为硝酸钾的溶解度随温度的升高而增大,所以升温可使20℃时未溶解的硝酸钾继续溶解;
B、因为硝酸钾的溶解度随温度的升高而增大,所以降温会使原来饱和的溶液析出晶体;
C、加硝酸钾不能改变硝酸钾的溶解能力,所以该方式不能使未溶的硝酸钾溶解;
D、温度不变时加入溶剂可多溶解溶质,所以该方式能使未溶的硝酸钾溶解;
(4)根据硝酸钾的溶解度随温度的降低而减小,所以要使溶质析出就需要使溶液的温度降低;
A、加冰可使溶液温度降低;
B、氧化钙溶于水放热,会使溶液温度升高;
C、硝酸铵溶于水会吸热导致溶液温度降低;
D、氢氧化钠溶于水会放热,导致溶液温度升高;
(5)A、在不知道溶液总质量大小的前提下,无法判断溶液中溶质的多少;
B、由于60℃时硝酸钾的溶解度是110g,所以该温度下饱和溶液的溶质与溶剂的质量比是110:100,因此溶质质量一定比溶剂多;
C、60℃时硝酸钾的溶解度是110g,所以该温度下饱和溶液的溶质质量分数为: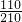 ×100%=52.4%,而40℃时硝酸钾的溶解度是63.9g,所以该温度下饱和溶液的溶质质量分数为
×100%=52.4%,而40℃时硝酸钾的溶解度是63.9g,所以该温度下饱和溶液的溶质质量分数为 ×100%=39.0%,所以60℃硝酸钾饱和溶液的溶质质量分数一定大于40℃硝酸钾饱和溶液的溶质质量分数;
×100%=39.0%,所以60℃硝酸钾饱和溶液的溶质质量分数一定大于40℃硝酸钾饱和溶液的溶质质量分数;
故答案为:(1)水;(2)饱和;(3)AD;(4)AC;(5)BC;
分析:(1)依据水是常用的溶剂解决;
(2)依据20℃时硝酸钾的溶解度分析判断;
(3)依据硝酸钾的溶解度随温度的升高而升高以及增加溶质的溶解量常用的方法解决;
(4)根据硝酸钾的溶解度随温度的降低而减小的规律进行分析解决;
(5)依据60℃时硝酸钾的饱和溶液的溶解度对相关问题进行分析探讨;
点评:此题是对溶解度知识的考查,解决的关键是利用溶解度的知识对溶液进行分析,并利用降温使溶质析出的相关知识进行解题的探讨.
(2)由于20℃时硝酸钾的溶解度是31.6g,所以20℃时,向100g水中加入31.6g硝酸钾,充分溶解后恰好得该温度下硝酸钾的饱和溶液;
(3)A、因为硝酸钾的溶解度随温度的升高而增大,所以升温可使20℃时未溶解的硝酸钾继续溶解;
B、因为硝酸钾的溶解度随温度的升高而增大,所以降温会使原来饱和的溶液析出晶体;
C、加硝酸钾不能改变硝酸钾的溶解能力,所以该方式不能使未溶的硝酸钾溶解;
D、温度不变时加入溶剂可多溶解溶质,所以该方式能使未溶的硝酸钾溶解;
(4)根据硝酸钾的溶解度随温度的降低而减小,所以要使溶质析出就需要使溶液的温度降低;
A、加冰可使溶液温度降低;
B、氧化钙溶于水放热,会使溶液温度升高;
C、硝酸铵溶于水会吸热导致溶液温度降低;
D、氢氧化钠溶于水会放热,导致溶液温度升高;
(5)A、在不知道溶液总质量大小的前提下,无法判断溶液中溶质的多少;
B、由于60℃时硝酸钾的溶解度是110g,所以该温度下饱和溶液的溶质与溶剂的质量比是110:100,因此溶质质量一定比溶剂多;
C、60℃时硝酸钾的溶解度是110g,所以该温度下饱和溶液的溶质质量分数为:
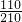 ×100%=52.4%,而40℃时硝酸钾的溶解度是63.9g,所以该温度下饱和溶液的溶质质量分数为
×100%=52.4%,而40℃时硝酸钾的溶解度是63.9g,所以该温度下饱和溶液的溶质质量分数为 ×100%=39.0%,所以60℃硝酸钾饱和溶液的溶质质量分数一定大于40℃硝酸钾饱和溶液的溶质质量分数;
×100%=39.0%,所以60℃硝酸钾饱和溶液的溶质质量分数一定大于40℃硝酸钾饱和溶液的溶质质量分数;故答案为:(1)水;(2)饱和;(3)AD;(4)AC;(5)BC;
分析:(1)依据水是常用的溶剂解决;
(2)依据20℃时硝酸钾的溶解度分析判断;
(3)依据硝酸钾的溶解度随温度的升高而升高以及增加溶质的溶解量常用的方法解决;
(4)根据硝酸钾的溶解度随温度的降低而减小的规律进行分析解决;
(5)依据60℃时硝酸钾的饱和溶液的溶解度对相关问题进行分析探讨;
点评:此题是对溶解度知识的考查,解决的关键是利用溶解度的知识对溶液进行分析,并利用降温使溶质析出的相关知识进行解题的探讨.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 28、下列数据是硝酸钾固体在不同温度时的溶解度.
28、下列数据是硝酸钾固体在不同温度时的溶解度.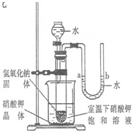 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.