题目内容
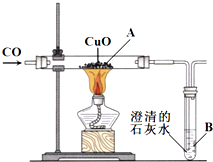 图为王涛同学设计的一氧化碳还原氧化铜的装置图:
图为王涛同学设计的一氧化碳还原氧化铜的装置图:a.如果反应持续较长时间,图中B处的实验现象是:
澄清石灰水先变浑浊;持续实验一段时间后,试管内液体又变澄清
澄清石灰水先变浑浊;持续实验一段时间后,试管内液体又变澄清
;写出实验中B处发生反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O;CaCO3+H2O+CO2=Ca(HCO3)2
Ca(OH)2+CO2=CaCO3↓+H2O;CaCO3+H2O+CO2=Ca(HCO3)2
.b.王涛同学欲研究其反应后残留物的组成成分.请你参与此项研究,并将你的假设、实验内容与操作、现象及结论填入表中.
| 假设 | 实验内容与操作 | 观察到的现象 | 解释或结论 |
残留固体成分为铜 残留固体成分为铜 |
取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡. 取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡. |
固体不溶解,溶液颜色没有变化(或无明显现象) 固体不溶解,溶液颜色没有变化(或无明显现象) |
残留物全部为铜 残留物全部为铜 |
分析:a、一氧化碳具有还原性,能与氧化铜在加热条件下生成铜和二氧化碳,生成的二氧化碳能使澄清的石灰水变浑浊,但如果反应持续较长时间,二氧化碳能与水、碳酸钙生成可溶性的碳酸氢钙,据此进行分析解答.
b、反应后残留物的组成成分可能是完全反应生成的铜,也可能是不完全反应生成的铜和剩余的氧化铜;氧化铜属于金属氧化物,能与酸反应,而铜不与酸反应,据此设计实验方案证明即可.
b、反应后残留物的组成成分可能是完全反应生成的铜,也可能是不完全反应生成的铜和剩余的氧化铜;氧化铜属于金属氧化物,能与酸反应,而铜不与酸反应,据此设计实验方案证明即可.
解答:解:a、一氧化碳具有还原性,能与氧化铜在加热条件下生成铜和二氧化碳,生成的二氧化碳能使澄清的石灰水变浑浊,反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
如果反应持续较长时间,二氧化碳能与水、碳酸钙生成可溶性的碳酸氢钙,试管内液体又变澄清了,反应的化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2.
b、若残留固体成分为铜,可取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡,如果固体不溶解,溶液颜色没有变化,说明残留物不含氧化铜,全部为铜.
若残留固体成分为铜和氧化铜,可取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡,如果固体部分溶解,溶液由无色变为蓝色,说明残留物为氧化铜和铜的混合物.
故答案为:a、澄清石灰水先变浑浊;持续实验一段时间后,试管内液体又变澄清.
Ca(OH)2+CO2=CaCO3↓+H2O;CaCO3+H2O+CO2=Ca(HCO3)2.
b、
如果反应持续较长时间,二氧化碳能与水、碳酸钙生成可溶性的碳酸氢钙,试管内液体又变澄清了,反应的化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2.
b、若残留固体成分为铜,可取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡,如果固体不溶解,溶液颜色没有变化,说明残留物不含氧化铜,全部为铜.
若残留固体成分为铜和氧化铜,可取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡,如果固体部分溶解,溶液由无色变为蓝色,说明残留物为氧化铜和铜的混合物.
故答案为:a、澄清石灰水先变浑浊;持续实验一段时间后,试管内液体又变澄清.
Ca(OH)2+CO2=CaCO3↓+H2O;CaCO3+H2O+CO2=Ca(HCO3)2.
b、
| 假设 | 实验内容与操作 | 观察的现象 | 解释或结论 |
| 假设一:残留固体成分为铜 | 取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡. | 固体不溶解,溶液颜色没有变化(或无明显现象) | 残留物全部为铜 |
| 假设二:残留固体成分为铜和氧化铜 | 取少量样品于试管中,再加入过量的稀硫酸或稀盐酸,充分振荡. | 固体部分溶解,溶液由无色变为蓝色 | 残留物为氧化铜和铜的混合物 |
点评:本题难度不是很大,掌握一氧化碳还原氧化铜的实验原理、二氧化碳的化学性质、酸的化学性质等是正确解答本题的关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目