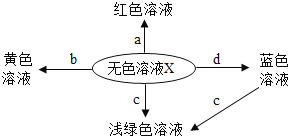
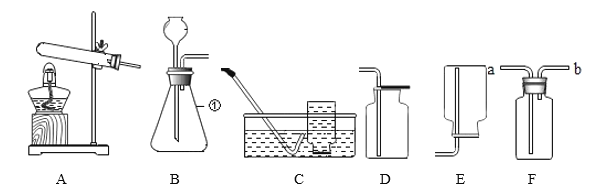
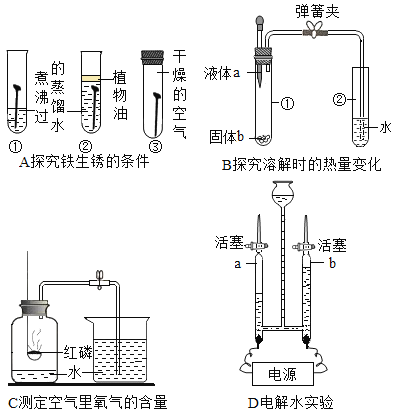
题目内容
【题目】通过观察下列实验现象,能达到实验目的是( )
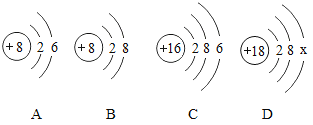
A.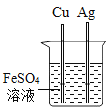 验证 Fe、Cu、Ag 的金属活动性强
验证 Fe、Cu、Ag 的金属活动性强
B.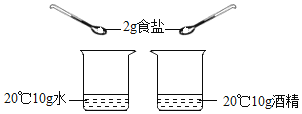 探究溶剂种类对物质溶解性的影响
探究溶剂种类对物质溶解性的影响
C. 验证质量守恒定律
验证质量守恒定律
D.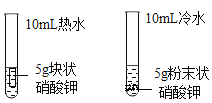 探究影响物质溶解速率的因素
探究影响物质溶解速率的因素
【答案】B
【解析】
A、把铜片、银片分开平行插入FeSO4溶液中,均不反应,说明了活动性铁>铜,铁>银,但无法确定银和铜的活动性强弱,故实验方案不能达到实验目的,故A错误;
B、图中实验,温度相同,溶质质量相同,溶剂的质量相同,溶剂的种类不同,可以探究溶剂种类对物质溶解性的影响,故选项实验能达到目的,故B正确;
C、盐酸和锌反应生成氯化锌和氢气,有气体生成,所以验证质量守恒定律时要在密闭容器内,而不是烧杯内,故实验方案不能达到实验目的,故C错误;
D、图示实验,硝酸钾的形状不同、水温不同,不能探究影响物质溶解速率的因素,故实验装置不能够达到实验目的,故D错误。
故选B。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】中医药是中华文明的重要组成部分。中医药在2020抗击新冠肺炎“战疫”中起重要的作用。初中常见的很多化学物质都是中医常用的药物。芒硝的主要成分是硫酸钠,在中医药中常用于湿热积滞、腹满胀痛、大便燥结等病症治疗。芒硝广泛分布于我国各地,尤其以盐碱地分布较多。
小青和小竹在了解芒硝的基本信息后,准备用盐湖水制备少量的Na2SO4晶体。
[查阅资料]
I.盐湖水中的溶质是NaCl、Na2CO3和Na2SO4.
II. NaCl、Na2CO3和Na2SO4在水中不同温度下的溶解度如下表所示:
0°C | 10°C | 20°C | 30°C | 40°C | |
NaCl | 35.7g | 35.8g | 36.0g | 36.3g | 36.6g |
Na2CO3 | 7g | 12.2g | 21.8g | 39.7g | 48.8g |
Na2SO4 | 4.9g | 9.1g | 19.5g | 40.8g | 48.8g |
(1)若要证明盐湖水中含有NaCl、Na2CO3 和Na2SO4,可依次加入适量的__________(选填字母),看到相应现象即可证明.
A AgNO3、H2SO4、BaCl2
B HCl、Ba(NO3)2、AgNO3
C HNO3、Ba(NO3)2、AgNO3
[进行实验]用盐湖水制取少量Na2SO4晶体
小青方案 | 取少盐湖水,蒸发浓缩,降温结晶,过滤,洗涤,干燥 |
[实验讨论]
(2)同学们讨论后认为小青的方案存在问题,因为用小青的方案得到的晶体除了含有硫酸钠外,还含有____晶体杂质。小竹在小青方案的基础上进行了改进,从而达到实验目的,
(3)小青的实验方案中“洗涤晶体”这一操作最好使用饱和_____________溶液洗而不用水洗,以防止硫酸钠固体溶于水造成晶体的损失。
[实验拓展]小湖同学想通过实验测得一定质盐湖水中Na2CO3的溶质质量分数,设计了下图所示装置进行实验,通过测定装D中氢氧化钠溶液的质量变化。然后计算,从而达到实验目的。
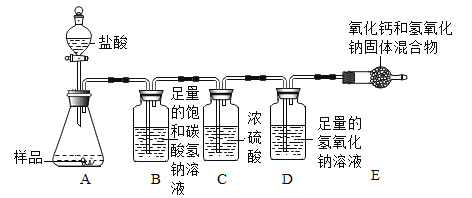
(4)装置B的作用是:_______________________。
(5)若将装置C和D颠倒位置,则通过计算得出Na2CO3的溶质质量分数__________ (填“偏大”、 “偏小”或“无影响”) .