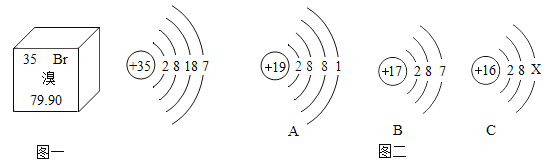
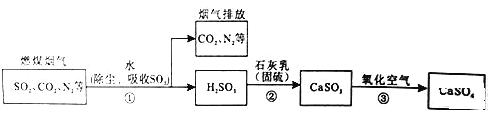
题目内容
【题目】某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:
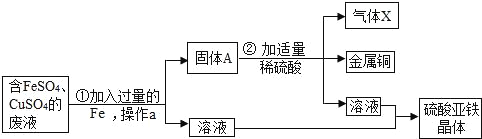
(1)固体A中含有______
(2)步骤①中反应的化学方程式为_________________
(3)操作a的名称为______
(4)理论上所得硫酸亚铁晶体的质量______(填“>”“<”或“=”)原废液中硫酸亚铁的质量。
【答案】铁,铜;Fe+CuSO4═FeSO4+Cu;过滤;>。
【解析】
由于目的是获得铜单质和硫酸亚铁,所以将过量的金属铁加入到含有FeSO4、CuSO4的废液中,经过过滤后得到单质的铜、铁及硫酸亚铁溶液,再用稀硫酸将过量的铁除去,得到单质的铜和硫酸亚铁溶液,据此分析解答。
(1)固体A中含有铁、铜;(2)步骤①中发生的反应是铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,反应的化学方程式为Fe+CuSO4═FeSO4+Cu;(3)操作a是将固体和液体分离,名称为过滤;(4)由于加入的稀硫酸与加入的过量的铁反应生成硫酸亚铁。故理论上所得硫酸亚铁晶体的质量>原废液中硫酸亚铁的质量。

【题目】分析处理图表中的信息是学习化学的一种重要方法,如表是NH4Cl和KNO3在不同温度时的溶解度数据:
温度/℃ | 10 | 30 | 50 | 70 | |
溶解度/g | NH4Cl | 33.3 | 41.4 | 50.4 | 55.2 |
KNO3 | 20.9 | 45.8 | 85.5 | 110 | |
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH4Cl的溶解度为______g.
(2)NH4Cl和KNO3的溶解度受温度影响比较大的物质是________(填化学式).
(3)欲配制质量分数为10%的KNO3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和________.
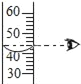
(4)烧杯中A中是60℃时,含有100g水的NH4Cl不饱和溶液,经过如图1的变化过程(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为______g.
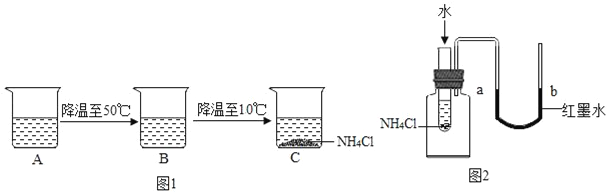
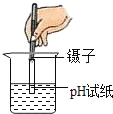
(5)某同学欲验证NH4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到____现象得以验证.
A.a端液面高于b端液面
B.a端液面低于b端液面.